
| A. | 澄清石灰水与少量苏打溶液混合:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| B. | 过氧化钠溶于水:2022-+2H2O═4OH-+O2↑ | |
| C. | 将过量二氧化硫气体通入氨水中:SO2+NH3•H2O═HSO3-+NH4+ | |
| D. | 向Ba(OH)2溶液中滴加稀硫酸:Ba2++OH-+H++SO42-═BaSO4↓+H2O |
分析 A.苏打为碳酸钠,应该为碳酸根离子;
B.过氧化钠在离子方程式中不能拆开;
C.二氧化硫过量,二者反应生成亚硫酸氢铵;
D.氢离子、氢氧根的计量数错误.
解答 解:A.澄清石灰水与少量苏打溶液混合,二者反应生成碳酸钙沉淀和氢氧化钠,正确的离子方程式为:Ca2++CO32-═CaCO3↓,故A错误;
B.过氧化钠溶于水生成氢氧化钠和氧气,过氧化钠需要保留化学式,正确的离子方程式为:2Na2O2+2H2O═4OH-+4Na++O2↑,故B错误;
C.将过量二氧化硫气体通入氨水中,反应生成亚硫酸氢铵,反应的离子方程式为:SO2+NH3•H2O═HSO3-+NH4+,故C正确;
D.向Ba(OH)2溶液中滴加稀硫酸,反应生成硫酸钡沉淀和水,正确的离子方程式为:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O,故D错误;
故选C.
点评 本题考查了离子方程式的正误判断,为高考的高频题,属于中等难度的试题,注意掌握离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等.


科目:高中化学 来源: 题型:解答题
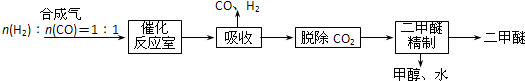
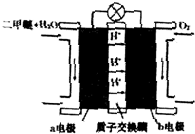
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuSO4 | B. | NaOH | C. | H2SO4 | D. | HC1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤⑦ | B. | ①②③⑤⑥⑦ | C. | ①②③④ | D. | ②③⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
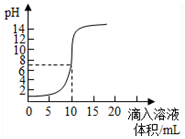
| A. | 原来盐酸的物质的量浓度为0.1mol•L-1 | |
| B. | 可以选择红色石蕊作为指示剂 | |
| C. | 氢氧化钠的物质的量浓度为0.1mol•L-1 | |
| D. | pH为7时加入的氢氧化钠的物质的量为0.1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在江河入海处易形成三角洲 | |
| B. | AgNO3溶液中滴入同浓度NaCl溶液,生成白色沉淀 | |
| C. | 卤水点豆腐 | |
| D. | 同一钢笔同时使用不同牌号的墨水易发生堵塞 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
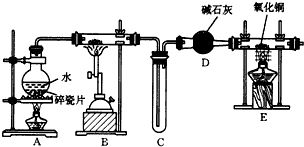
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室制备乙酸乙酯,是将3mL乙醇加入一支试管中,然后边振荡试管,边慢慢加入2mL浓H2SO4和2mL乙酸,按如图连接好装置,在酒精灯上加热.观察现象.
实验室制备乙酸乙酯,是将3mL乙醇加入一支试管中,然后边振荡试管,边慢慢加入2mL浓H2SO4和2mL乙酸,按如图连接好装置,在酒精灯上加热.观察现象.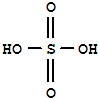 )溶于乙醇中并不是简单的物理溶解而是伴随着化学反应,生成了硫酸乙酯(
)溶于乙醇中并不是简单的物理溶解而是伴随着化学反应,生成了硫酸乙酯( )和硫酸二乙酯(
)和硫酸二乙酯(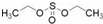 ).
).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com