

| A. | 混合物中一定不存在FeCl2和NaCl | |
| B. | 反应④的离子方程式为:AlO2-+H++H2O=Al(OH)3↓ | |
| C. | 混合物中一定含有Al、(NH4)2SO4、MgCl2三种物质,无法判断是否含有AlCl3 | |
| D. | 白色沉淀5.80g是Mg(OH)2 |
分析 根据生成气体通过碱石灰体积不变(无酸性气体),而通过浓硫酸体积减小,说明剩余的 6.72 L气体为氢气,即原固体中一定含有金属Al,且其质量为$\frac{6.72L}{\frac{22.4L/mol}{1.5}}$×27 g/mol=5.4 g.生成氨气的物质的量为$\frac{11.2L-6.72L}{22.4L/mol}$=0.2 mol,则原固体中一定含有 0.1 mol (NH4)2SO4,其质量为13.2 g,得到白色沉淀久置不变色,说明无FeCl2(氢氧化亚铁易被氧化为红棕色的氢氧化铁),因为NaOH过量,所以白色沉淀不可能含有氢氧化铝,则说明5.8 g白色沉淀为Mg(OH)2,为0.1 mol,则固体中MgCl2为0.1 mol,质量为9.5g,无色溶液中有Al与过量NaOH溶液反应后得到的NaAlO2,根据Al、(NH4)2SO4和MgCl2的质量和判断是否含有AlCl3、NaCl.
解答 解:A.白色沉淀久置不变色,说明无FeCl2(氢氧化亚铁易被氧化为红棕色的氢氧化铁),28.1g固体中:含有金属Al:5.4 g,(NH4)2SO4:13.2 g,MgCl2:9.5g,
5.4 g+13.2 g+9.5 g=28.1g,即原固体中一定不含有NaCl,故A正确;
B.28.1g固体中:含有金属Al:5.4 g,(NH4)2SO4:13.2 g,MgCl2:9.5g,与过量NaOH溶液反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,(NH4)2SO4+2NaOH=Na2SO4+2H2O+2NH3↑,MgCl2+2NaOH=Mg(OH)2↓+2NaCl,最后无色溶液为NaAlO2、Na2SO4、NaCl、NaOH混合液,加适量的稀盐酸,所以反应④是偏铝酸根与氢离子反应生成氢氧化铝沉淀,AlO2-+H++H2O=Al(OH)3↓,故B正确;
C.28.1g固体中:含有金属Al:5.4 g,(NH4)2SO4:13.2 g,MgCl2:9.5g,5.4 g+13.2 g+9.5 g=28.1g,即原固体中一定不含有NaCl、AlCl3,故C错误;
D.因为NaOH过量,所以白色沉淀不可能含有氢氧化铝,MgCl2+2NaOH=Mg(OH)2↓+2NaCl,则说明5.8 g白色沉淀为Mg(OH)2,故D正确;
故选C.
点评 本题考查物质的分离、提纯以及检验,侧重于元素化合物知识的综合应用,为高考常考查题型,注意根据相关数据进行判断,题目难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


| 沸点℃ | 密度g/cm3 | 溶解性 | |
| 溴 | 59 | 3.119 | 水中溶解度小,易溶于有机溶剂 |
| 苯 | 80 | 0.8765 | 难溶于水,与有机溶剂互溶 |
| 溴苯 | 156 | 1.50 | 难溶于水,与有机溶剂互溶 |
| 序号 | 实验步骤 | 预期现象 | 结论 |
| 1 | 将锥形瓶中液体转入分液漏斗,加入适量四氯化碳,振荡后分液.分别取少量上层无色溶液于试管A、B中 | ||
| 2 | 锥形瓶中液体含大量 Br- | ||
| 3 | 锥形瓶中液体含大量 H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石墨烯弹性气凝胶可用作处理海上原油泄漏的吸油材料 | |
| B. | 雾霾中含有大量的PM2.5,PM2.5又称为“细颗粒物”,它容易附着有毒有害物质,尤其是重金属,对人体造成危害 | |
| C. | 新的铁基超导材料中Fe的化合价呈+2、+3价 | |
| D. | 该分子催化剂可将一次能源太阳能直接转化成二次能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
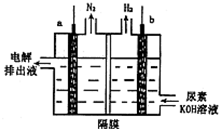 电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图如图(电解池中隔膜仅阻止气体通过,a、b极均为惰性电极).下列说法正确的是( )
电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图如图(电解池中隔膜仅阻止气体通过,a、b极均为惰性电极).下列说法正确的是( )| A. | 电解时,b极是阴极放出H2,发生氧化反应 | |
| B. | 溶液中OH-逐渐向b极移动 | |
| C. | 电解时,a极的电极反应式为:CO(NH2)2+8OH--6e═CO32-+N2↑+6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,氨水与(NH4)2SO4溶液混合后pH=7的溶液中,c(NH4+):c(S042-) | |
| B. | 相同温度下,0.2 mo I•L-1乙酸溶液与0.1 mo I•L-1乙酸溶液中,c(H+)之比 | |
| C. | Na2C03溶液中,c(Na+):c(C032-) | |
| D. | 常温下,pH=12的Ba(OH)2溶液与pH=12的KOH溶液中,c[Ba(OH)2]:c(KOH) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com