


科目:高中化学 来源: 题型:
| 微粒代号 | A | B | C | D | E | F | G |
| 原子核数 | 单核 | 单核 | 双核 | 多核 | 单核 | 多核 | 多核 |
| 电荷数(单位电荷) | 0 | 1+ | 1- | 0 | 2+ | 1+ | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 待提纯的物质 | 选用的试剂 | 操作方法 |
| A | NaCl(Na2CO3) | 盐酸 | 蒸发结晶 |
| B | CO2(CO) | O2 | 点燃 |
| C | Zn (Cu) | 稀硫酸 | 过滤 |
| D | CO2(HCl) | 饱和碳酸钠溶液 | 洗气 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
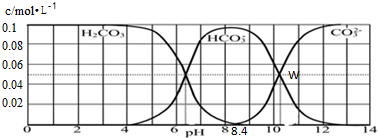
| A、pH=11的溶液中,c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) |
| B、W点所表示的溶液中:c(Na+)=0.15mol?L-1 |
| C、pH=8.4的溶液中,c(OH-)=c(H+)+c(HCO3-)+2c(CO32-) |
| D、pH=9时,c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向一定量的AgNO3溶液中加入氨水至沉淀消失 |
| B、向FeCl3溶液中加入KSCN溶液 |
| C、向一定量的CuSO4溶液中加入氨水至沉淀消失 |
| D、除去铁粉中的铝粉可以用强碱溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定有CO32-离子存在 |
| B、不能确定是否存在HCO3-离子存在 |
| C、一定有C1-离子存在 |
| D、一定有SO32-离子存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HR溶液的导电性较弱,所以HR属于弱酸 |
| B、某化合物溶于水导电,该化合物一定是电解质 |
| C、NaCl是电解质,食盐的水溶液也是电解质 |
| D、根据电解质在水溶液中的电离程度,将电解质分为强电解质和弱电解质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com