
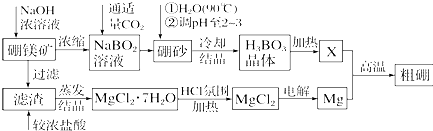
分析 硼镁矿主要成分为Mg2B2O5•H2O,硼砂的化学式为Na2B4O7•10H2O.利用硼镁矿制取金属镁及粗硼的工艺流程中硼镁矿加入氢氧化钠浓溶液过滤得到氯化镁,加入浓盐酸溶解通过蒸发浓缩得到氯化镁结晶水合物,在氯化氢气流中加热得到氯化镁固体,电解得到镁;滤液中主要是NaBO2,通入适量二氧化碳气体得到硼砂,溶于热后,用H2SO4调pH2~3制取H3BO3,加热得到B2O3;
(1)硼砂的化学式为Na2B4O7•10H2O,依据元素化合价标注计算硼元素化合价;用H2SO4调pH2~3,硼砂中的Na2B4O7在酸溶液中生成H3BO3 ;X为H3BO3晶体加热脱水的产物得到B2O3,镁和得到B2O3反应生成氧化镁和硼;
(2)氯化镁在水溶液中水解生成氢氧化镁;惰性电极电解MgCl2溶液阴极氢离子得到电子生成氢气,水的电离平衡破坏,水电离生成氢氧根离子浓度增大,和镁离子形成氢氧化镁沉淀,合并写出电极反应;
(3)燃料电池中正极上是过氧化氢得到电子生成水;依据电解质溶液PH变化结合电池反应计算镁离子浓度;PH=6计算氢氧根离子浓度,结合生成镁离子浓度计算浓度商和溶度积常数比较分析是否生成氢氧化镁沉淀;
(4)根据关系式B~BI3~$\frac{3}{2}$I2~3S2O32-及滴定数据计算出粗硼中硼的含量.
解答 解:(1)硼砂的化学式为Na2B4O7•10H2O,钠元素化合价为+1价,氧元素化合价-2价,依据化合价代数和计算得到硼元素化合价为+3价;用H2SO4调pH2~3,硼砂中的Na2B4O7在酸溶液中生成H3BO3 ,反应的离子方程式为:B4O72-+2H++5H2O=4H3BO3,X为H3BO3晶体加热脱水的产物是B2O3,镁和得到B2O3反应生成氧化镁和硼,反应的化学方程式为:3Mg+B2O3$\frac{\underline{\;高温\;}}{\;}$2B+3MgO,反应中元素化合价降低的做氧化剂,硼元素化合价+3价变化为0价,则B2O3做氧化剂;
故答案为:+3;B4O72-+2H++5H2O=4H3BO3;3Mg+B2O3$\frac{\underline{\;高温\;}}{\;}$2B+3MgO;
(2)MgCl2•7H2O需要在HCl氛围中加热,是为了防止氯化镁水解生成氢氧化镁;若用惰性电极电解MgCl2溶液,阴极氢离子得到电子生成氢气,水的电离平衡破坏,水电离生成氢氧根离子浓度增大,和镁离子形成氢氧化镁沉淀,合并写出阴极反应式为:2H2O+Mg2++2e-=H2↑+Mg(OH)2↓;
故答案为:防止MgCl2水解生成Mg(OH)2;2H2O+Mg2++2e-=H2↑+Mg(OH)2↓;
(3)镁-H2O2酸性燃料电池的反应机理为Mg+H2O2+2H+═Mg2++2H2O,正极上是过氧化氢得到电子生成水的反应,正极反应式H2O2+2H++2e-=2H2O;若起始电解质溶液pH=1,则pH=2时溶液中,氢离子浓度减小0.1mol/L-0.01mol/L=0.09mol/L,依据反应方程式得到Mg2+离子浓度=0.045mol/L;Ksp[Mg(OH)2]=5.6×10-12,当溶液pH=6时,c(OH-)=10-8mol/L,则Qc=c(Mg2+)×c2(OH-)=0.045mol/L×10-16mol/L=4.5×10-18<Ksp[Mg(OH)2],说明无氢氧化镁沉淀生成;
故答案为:H2O2+2H++2e-=2H2O;0.045 mol•L-1;没有;
(4)硫代硫酸钠的物质的量为:0.30mol/L×0.018L=0.0054mol,I2+2S2O32-=2I-+S4O62-,
根据关系式:B~BI3~$\frac{3}{2}$I2~3S2O32-,
n(B)=$\frac{1}{3}$n(S2O32-)=0.0018mol,
硼的质量为:10.8g/mol×0.0018mol=0.01944g,粗硼中硼的含量为:$\frac{0.01944g}{0.0200g}$×100%=97.2%,
故答案为:97.2%.
点评 本题考查了盐类的水解、原电池原理和电解池原理的分析,沉淀溶解平衡的计算应用,题目难度稍大,计算是难点,计算时要充分利用题目所给数量关系和表中数据,根据质量关系和质量分数的概念快速解题.


科目:高中化学 来源: 题型:选择题
| A. | 海水淡化的主要方法有蒸馏法、电渗析法、离子交换法、反渗透法等 | |
| B. | 海水中的无机盐主要以Na+、Mg2+、K+、Ca2+、SO42-、Cl-、Br-等形式存在 | |
| C. | 海生植物如海带中存在较高浓度的I2,具有很高的开发利用价值 | |
| D. | 从海水中可以提取核反应材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
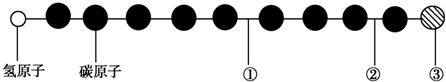
| A. | 该物质是烃的含氧衍生物 | B. | ①处的化学键是碳碳双键 | ||
| C. | ②处的化学键是碳碳单键 | D. | ③处的原子可能是氯原子或氟原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素 | X | Y | Z | R | T |
| 原子半径/nm | 0.037 | 0.077 | 0.074 | 0.186 | 0.102 |
| 主要化合价 | +1 | +4、-4 | -2 | +1 | +6、-2 |
| A. | X、Y、Z 位于同一周期 | |
| B. | R 与 Z 所形成的化合物均只含离子键 | |
| C. | 氢化物的沸点:Y<Z<T | |
| D. | 第一电离能:Y<Z |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:3Ba2++3SO42-+2Al3++6OH-═2BaSO4↓+2Al(OH)3↓ | |
| B. | 醋酸除去水垢:CaCO3+2H+═Ca2++CO2↑+H2O | |
| C. | 碳酸氢钠和偏铝酸钠反应:HCO3-+AlO2-+H2O═CO32-+Al(OH)3↓ | |
| D. | 向硫酸铜中加入过量氨水:Cu2++2NH3•H2O═Cu(OH)2↓+2NH4+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com