
某学生利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置。
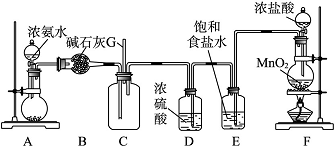
请回答下列问题:
(1)装置A中的烧瓶内固体不可以选用______(填序号)。
A.生石灰 B.碱石灰
C.五氧化二磷 D.烧碱
(2)B装置的作用是______________________;E装置的作用是_____________________。
(3)通入C装置的两根导管左边较长、右边较短,目的是____________ ________________。
________________。
(4)装置F中发生反应的化学方程式是_________________________________________。
(5)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一。请写出反应的化学方程式:________________________________________________________。
(6)从装置C的G处逸出的尾气中可能含有黄绿色的有毒气体,如何处理?
________________________________________________________________________
答案 (1)C (2)干燥氨气 除去氯气中的氯化氢
(3)使密度较大的Cl2和密度较小的NH3能较快地混合均匀
(4)MnO2+4HCl(浓)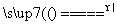 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(5)3Cl2+8N H3===N2+6NH4Cl
H3===N2+6NH4Cl
(6)在G处连接导管,直接把尾气通入盛有烧碱溶液的烧杯中
解析 (1) 装置A制取氨气,可用浓氨水与碱石灰(或烧碱或生石灰等),但不能用五氧化二磷,因其与水反应后生成磷酸,能与氨水反应;(2)B装置中盛放的碱石灰,用来干燥氨气;E装置中盛放的饱和食盐水,用来除去氯气中混有的氯化氢气体;(3)由于氨气的密度小,氯气的密度大,密度小的氨气从长管进入向上扩散,密度大的氯气从短管进入向下扩散,这样能较快地充分混合;(6)黄绿色的气体是氯气,依据氯气的性质,可用烧碱溶液吸收。
装置A制取氨气,可用浓氨水与碱石灰(或烧碱或生石灰等),但不能用五氧化二磷,因其与水反应后生成磷酸,能与氨水反应;(2)B装置中盛放的碱石灰,用来干燥氨气;E装置中盛放的饱和食盐水,用来除去氯气中混有的氯化氢气体;(3)由于氨气的密度小,氯气的密度大,密度小的氨气从长管进入向上扩散,密度大的氯气从短管进入向下扩散,这样能较快地充分混合;(6)黄绿色的气体是氯气,依据氯气的性质,可用烧碱溶液吸收。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
根据元素周期表和元素周期律分析,下列推断中错误的是( )
A.铍的原子失去电子能力比镁弱 B.砹的氢化物不稳定
C.硒化氢比硫化氢稳定 D.氢氧化锶比氢氧化钙的碱性强
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是 ( )
①离子化合物含离子键,也可能含极性键或非极性键
②共价化合物含共价键,也可能含离子键
③含金属元素的化合物不一定是离子化合物
④由非金属元素组成的化合物一定是共价化合物
⑤由分子组成的物质中一定存在共价键
⑥熔融状态能导电的化合物是离子化合物
A.①③⑥ B.②④⑥ C.②③④ D.①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象如下表。请你帮助该同学整理并完成实验报告:
| 实验方案 | 实验现象 |
| ①用砂纸擦后的镁带与沸水反应,再向反应后溶液中滴加酚酞 | (A)浮于水面,熔成小球,在水面上游动,随之消失,溶液变红 |
| ②向新制的H2S饱和溶液中滴加新制的氯水 | (B)产生气体,可在空气中燃烧,溶液变为浅红色 |
| ③钠与滴有酚酞试液的冷水反应 | (C)反应不十分强烈,产生的气体可在空气中燃烧 |
| ④镁带与2mol/L盐酸反应 | (D)剧烈反应,产生可燃气体 |
| ⑤铝条与2mol/L盐酸反应 | (E)生成白色胶状沉淀,后来沉淀消失 |
| ⑥向AlCl3溶液中滴加NaOH溶液至过量 | (F)生成淡黄色沉淀 |
(1) 实验目的: 研究同周期元素性质递变规律
(2) 实验用品:
仪器: ①________②________③________④ 试管夹 ⑤ 镊子 ⑥ 小刀 ⑦ 玻璃片⑧ 砂纸等;
药品:钠、镁带、铝条、2mol/L的盐酸、新制的氯水、饱和的H2S溶液、AlCl3溶液、NaOH溶液等。
(3) 实验内容:(填写与实验方案相对应的实验现象)
①______②______③______④______⑤______⑥______(用A-F表示)
(4) 实验结论:
金属性: ________________ 非金属性: ________________
(5)写出⑥的总反应离子方程式:_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验设计能够成功的是( )
| 实验目的 | 实验操作 | |
| A | 该物质一定是氨气 | 该物质的水溶液能使红色石蕊试纸变蓝 |
| B | 除去硫酸钠溶液中少量氯化钠杂质 | 向含有氯化钠杂质的硫酸钠溶液中加入适量的硝酸银溶液,过滤 |
| C | 该溶液一定含有大量碳酸根离子 | 某物质的水溶液中加入盐酸产生无色无味气体 |
| D | 浓硝酸的氧化性强于稀硝酸 | 向盛有少量的浓硝酸、稀硝酸的两支试管中,分别加入大小相同的铜片 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各项操作中,不发生“先产生沉淀,然后沉淀又溶解”现象的是①向饱和碳酸钠溶液中通入过量的CO2;②向Na[Al(OH)4]溶液中逐滴加入过量的稀盐酸;③向AlCl3溶液中逐滴加入过量的稀氢氧化钠溶液;④向硅酸钠溶液中逐滴加入过量的盐酸 ( )。
A.①② B.①③ C.①④ D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究性学习小组对铝热反应实验展开研究。现行高中化学教材中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3的熔点、沸点数据如下:
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2 054 | 1 535 | 1 462 |
| 沸点/℃ | 2 467 | 2 980 | 2 750 | - |
Ⅰ.(1)某同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理?________(填“合理”或“不合理”)。
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是________,反应的离子方程式为___________________。
(3)实验室溶解该熔融物,在下列试剂中最适宜的试剂是________(填序号)。
A.浓硫酸 B.稀硫酸
C.稀硝酸 D.氢氧化钠溶液
Ⅱ.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量上述的熔融物与一定量很稀 的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴
的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴 加入
加入
4 mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题:
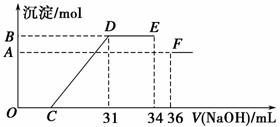
(1)图中OC段没有沉淀生成,此阶段发生反应的离子方程式为_____________。
(2)在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为_____________________________________________________________;上述现象说明溶液中________结合OH-的能力比________强(填离子符号)。
(3)B与A的差值为________mol。
(4)B点对应的沉淀的物质的量为________mol,C点对应的氢氧化钠溶液的体积为________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
诺贝尔物理学奖授予“光纤之父”英国华裔科学家高锟以及两位美国科学家威拉德·博伊尔和乔治·史密斯。光导纤维的主要成分是二氧化硅,下列关于二氧化硅的说法 正确的是( )
正确的是( )
A.二氧化硅是H2SiO3的 酸酐,因此能与水反应
酸酐,因此能与水反应
B.用二氧化硅制取单质硅时,当生成2.24 L(标况)气体时,得到2,8 g硅
C.6 g的二氧化硅中含有0.2 mol的共价键
D.二氧化硅不能与碳酸钠溶液反应,但能与碳酸钠固体在高温时发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
已知W、X、Y、Z为短周期元素,W、Z同主族,X、Y、Z 同周期,W的气态氢化物的稳定性大于Z的气态氢化物的稳定性,X、Y为金属元素,X的阳离子的氧化性小于Y的阳离子的氧化性。下列说法正确的是 ( )。
同周期,W的气态氢化物的稳定性大于Z的气态氢化物的稳定性,X、Y为金属元素,X的阳离子的氧化性小于Y的阳离子的氧化性。下列说法正确的是 ( )。
A.X、Y、Z、W的原子半径依次减小
B.W与X形成的化合物中只含离子键
C.W的气态氢化物的沸点一定高于Z的气态氢化物的沸点
D.若W与Y的原子序数相差5,则二者形成化合物的化学式一定为Y2W3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com