
【题目】下列物质中,既有离子键,又有共价键的是( )
A.H2O
B.CaCl2
C.KOH
D.Cl2
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】NH3及其盐都是重要的化工原料。
(1)用NH4Cl和Ca(OH)2制备NH3,反应发生、气体收集和尾气处理装置依次为_____________。

(2)按下图装置进行NH3性质实验。
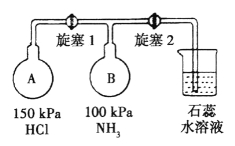
①先打开旋塞1,B瓶中的现象是_______________,原因是____________,稳定后,关闭旋塞1。
②再打开旋塞2,B瓶中的现象是_____________。
(3)设计实验,探究某一种因素对溶液中NH4Cl水解程度的影响。
限制试剂与仪器:固体NH4Cl、蒸馏水、100mL容量瓶、烧杯、胶头滴管、玻璃棒、药匙、天平、PH计、温度计、恒温水浴槽(可控制温度)
①实验目的:探究对溶液中NH4Cl水解程度的影响。
②设计实验方案,拟定实验表格,完整体现实验方案(列出能直接读取数据的相关物理量及需拟定的数据,数据用字母表示;表中V(溶液)表示所配制溶液的体积)。

③按实验序号I所拟数据进行实验,若读取的待测物理量的数值为Y,则NH4Cl水解反应得平衡转化率为______________ (只列出算式,忽略水自身电离的影响)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学反应的能量变化说法正确的是
A. 任何化学反应都伴随能量变化 B. 氧化还原反应一定是吸热反应
C. 化学反应过程中的能量变化都是热量变化 D. 化学键断裂放出能量,化学键形成吸收能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:(HF)2(g) ![]() 2HF(g) ΔH>0,且平衡体系的总质量m(总)与总物质的量n(总)之比在不同温度下随压强的变化曲线如图所示。下列说法正确的是
2HF(g) ΔH>0,且平衡体系的总质量m(总)与总物质的量n(总)之比在不同温度下随压强的变化曲线如图所示。下列说法正确的是
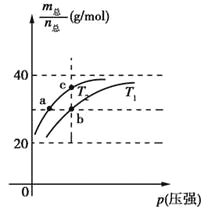
A.温度:T1<T2 B.平衡常数:K(a)=K(b)<K(c)
C.反应速率:vb>va D.当![]() =30g·mol-1时,n(HF):n[(HF)2]=2:1
=30g·mol-1时,n(HF):n[(HF)2]=2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C三种物质中均含有同一种元素M,它们之间有如下图所示的转化关系,(部分反应物质已略去)。A为一种金属单质,反应①②③均为化合反应,反应④为置换反应。下列有关说法正确的是

A.①中所加试剂只能是Cl2
B.③中需要加具有还原性的试剂
C.A与稀硝酸反应一定能实现元素M 在①中发生的价态变化
D.元素M在②中发生的价态变化也能通过加KI溶液实现
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(每空3分,共6分)根据下列叙述写出相应的热化学方程式:
(1)已知16 g固体硫完全燃烧时放出148.4 kJ的热量,写出表示硫的燃烧的热化学方程式:______________。
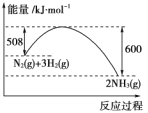
(2)如图是298 K、101 kPa时,N2与H2反应过程中能量变化的曲线图。该反应的热化学方程式___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】密度为0.910g/cm3氨水,质量分数为25.0%,该氨水用等体积的水稀释后,所得溶液的质量分数为
A.小于12.5% B.大于12.5% C.等于12.5% D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在浓度均为6 mol·L-1的盐酸和硫酸各100 mL溶液中,分别加入等质量的铁粉,充分反应后生成气体体积比为2∶3,则加入铁粉的质量是 ( )
A. 11.2 g B. 25.2 g C. 16.8 g D. 33.6 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以黄铜矿精矿为原料,制取硫酸铜及金属铜的工艺如下所示:
Ⅰ. 将黄铜矿精矿(主要成分为CuFeS2,含有少量CaO、MgO、Al2O3)粉碎
Ⅱ. 采用如下装置进行电化学浸出实验
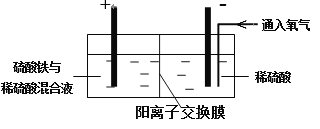
将精选黄铜矿粉加入电解槽阳极区,恒速搅拌,使矿粉溶解。在阴极区通入氧气,并加入少量催化剂。
Ⅲ. 一段时间后,抽取阴极区溶液,向其中加入有机萃取剂(RH)发生反应:
2RH(有机相)+Cu2+(水相)![]() R2Cu(有机相)+2H+(水相)
R2Cu(有机相)+2H+(水相)
分离出有机相,向其中加入一定浓度的硫酸,使Cu2+得以再生。
Ⅳ. 电解硫酸铜溶液制得金属铜。
(1)黄铜矿粉加入阳极区与硫酸及硫酸铁主要发生以下反应:
CuFeS2+4H+=Cu2++Fe2++2H2S
2Fe3++H2S=2Fe2++S↓+2H+
①阳极区硫酸铁的主要作用是 。
②电解过程中,阳极区Fe3+的浓度基本保持不变,原因是 。
(2)阴极区,电极上开始时有大量气泡产生,后有固体析出,一段时间后固体溶解。写出上述现象对应的反应式 。
(3)若在实验室进行步骤Ⅲ,分离有机相和水相的主要实验仪器是 ;加入有机萃取剂的目的是 。
(4)步骤Ⅲ,向有机相中加入一定浓度的硫酸,Cu2+得以再生的原理是 。
(5)步骤Ⅳ,若电解200mL0.5 mol/L的CuSO4溶液,生成铜3.2 g,此时溶液中离子浓度由大到小的顺序是 。(忽略电解前后溶液体积的变化)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com