
| n |
| V |
| 0.448L×24g |
| 22.4L |


 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:
| A、将FeCl3溶液加热蒸干得到FeCl3固体 |
| B、向Fe(NO3)2溶液中加少量盐酸,无明显现象 |
| C、向氢氧化镁悬浊液中滴加FeCl3溶液,无明显现象 |
| D、向 FeSO4溶液中滴加NaOH溶液,先出现白色沉淀,最终沉淀转化成红褐色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只有乙醇 |
| B、乙酸、乙醇 |
| C、只有乙酸乙酯 |
| D、乙酸乙酯、乙醇、乙酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 四种元素A、B、C、D位于元素周期表的前四周期,已知它们的核电荷数依次增加,且核电荷数之和为50;A元素原子的核外只有一个电子;B元素原子的L层p轨道中有2个电子;C元素原子与B元素原子的价层电子数相同;D原子的最外层电子数为1,其d轨道中的电子数与K层电子数之比为5:1.
四种元素A、B、C、D位于元素周期表的前四周期,已知它们的核电荷数依次增加,且核电荷数之和为50;A元素原子的核外只有一个电子;B元素原子的L层p轨道中有2个电子;C元素原子与B元素原子的价层电子数相同;D原子的最外层电子数为1,其d轨道中的电子数与K层电子数之比为5:1.查看答案和解析>>
科目:高中化学 来源: 题型:
 燃料电池是一种连续的将燃料和氧化剂的化学能直接转化为电能的化学电池.氢气、烃、肼、甲醇等液体或气体,均可以作燃料电池的燃料.请回答下列问题:
燃料电池是一种连续的将燃料和氧化剂的化学能直接转化为电能的化学电池.氢气、烃、肼、甲醇等液体或气体,均可以作燃料电池的燃料.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
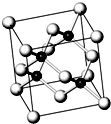 砷化镓属于第三代半导体,它能直接将电能转变为光能,砷化镓灯泡寿命是普通灯泡的100倍,而耗能只有其10%,推广砷化镓等发光二极管(LED)照明,是节能减排的有效举措.已知砷化镓的晶胞结构如图.试回答下列问题:
砷化镓属于第三代半导体,它能直接将电能转变为光能,砷化镓灯泡寿命是普通灯泡的100倍,而耗能只有其10%,推广砷化镓等发光二极管(LED)照明,是节能减排的有效举措.已知砷化镓的晶胞结构如图.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2 mol水的摩尔质量和1 mol水的摩尔质量 |
| B、200 mL 1 mol/L氯化钙溶液中c(Cl-)和100 mL 2 mol/L氯化钾溶液中c(Cl-) |
| C、64 g二氧化硫中氧原子数和标准状况下22.4 L一氧化碳中氧原子数 |
| D、20%NaOH溶液中NaOH的物质的量浓度和10%NaOH溶液中NaOH的物质的量浓度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com