
| A. | 1molNH5中含有5NA个N-H键 | |
| B. | NH5中既含有共价键,又含有离子键,是离子化合物 | |
| C. | NH5的熔、沸点高于NH3 | |
| D. | NH5固体投入少量水中可产生两种气体 |
分析 固体A的化学式为NH5,它的所有原子的最外层都符合相应稀有气体原子的最外层电子结构,化学式应为NH4H,为离子化合物,存在NH4+和H-,为离子化合物,以此解答该题.
解答 解:A.NH5为离子化合物,化学式为NH4H,1molNH5中含有4NA个N-H键,故A错误;
B.NH5为离子化合物,分子中存在NH4+和H-,为离子化合物,含有离子键,N-H键为共价键,故B正确;
C.NH5为离子晶体的熔沸点高于分子晶体,故C正确;
D.它与H2O反应,H-具有还原性,H2O具有氧化性,可生成氨气和氢气,反应的方程式为NH5+H2O═NH3•H2O+H2↑,NH3•H2O分解得到氨气,故D正确.
故选A.
点评 本题考查物质的结构和性质,为高频考点,侧重分析与应用能力的考查,注意把握离子化合物的结构特点以及物质的性质,题目难度不大.


 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧气量充足,燃烧充分 | B. | 固体燃料块越大燃烧越充分 | ||
| C. | 液体燃料燃烧时可以雾状喷出 | D. | 温度必须达到着火点 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
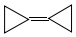 ,由于其具有特殊的电子结构一直受到理论化学家的关注.下列关于环丙烷叉环丙烷的说法错误的是( )
,由于其具有特殊的电子结构一直受到理论化学家的关注.下列关于环丙烷叉环丙烷的说法错误的是( )| A. | 一氯取代物有1种 | B. | 是环丙烷的同系物 | ||
| C. | 与环己二烯( 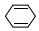 )是同分异构体 )是同分异构体 | D. | 所有的碳原子均在同一平面内 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2S的电子式: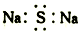 | B. | 二氧化硅的分子式:SiO2 | ||
| C. | 18O的原子结构示意图: | D. | HClO分子的结构式:H-Cl-O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{58}^{80}$Ce | B. | ${\;}_{58}^{138}$Ce | C. | ${\;}_{80}^{58}$Ce | D. | ${\;}_{80}^{138}$Ce |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向平衡体系中加入水,平衡正向移动,c (H+)增大 | |
| B. | 将水加热,Kw增大,pH不变 | |
| C. | 向水中加入少量硫酸氢钠固体,$\frac{c({H}^{+})}{c(O{H}^{-})}$增大 | |
| D. | 向水中加入少量NaOH固体,平衡正向移动,c(H+)降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
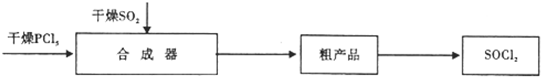
| 实验步骤 | 预期现象和结论 |
| 步骤1取少量吸收液于试管中滴加3moL.L-1H2SO4,至溶液呈酸性,然后将所得溶液分置于A、B试管中. | 无明显现象 |
| 步骤2:在A试管中滴加紫色石蕊试液 | 若先变红后褪色,证明有ClO-,否则无 |
| 步骤3:在B试管中滴加0.01mol•L-1KMnO4溶液 | 若紫红色褪去,证明有SO32-,否则无 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com