
[化拳——化学与技术](15分)
粉煤灰是燃煤电厂排出的主要固体废物。我国火电厂粉煤灰的主要氧化物组成为 等。 一种利用粉煤灰制取氧化铝的工艺流程如下:
等。 一种利用粉煤灰制取氧化铝的工艺流程如下:

(1)粉煤灰研磨的目的是 。
(2)第1次过滤时滤渣的主要成分有 (填化学式,下同)和 ,第3次过滤时滤渣的成分是
(3)在104℃用硫酸浸取时,铝的浸取率与时间的关系如图1,适宜的浸取时间为 h;铝的浸取率与 的关系如图2所示,从浸取率角度考虑,三种助溶剂NH4F、KF及NH4F与KF的混合物,在
的关系如图2所示,从浸取率角度考虑,三种助溶剂NH4F、KF及NH4F与KF的混合物,在 相同时,浸取率最高的是 (填化学式);用含氟的化合物作这种助溶剂的缺点是 (举一例)。
相同时,浸取率最高的是 (填化学式);用含氟的化合物作这种助溶剂的缺点是 (举一例)。


(4)流程中循环使用的物质有——和——。(填化学式)
(5)用盐酸溶解硫酸铝晶体,再通入HCl气体,析出A1C13·6H20,该过程能够发生的原因是
(6)用粉煤灰制取含铝化合物的主要意义是
(1)增大接触面积,提高浸取速率和浸取率
(2)SiO2;CaSO4;Al(OH)3
(3)2;NH4F;生产过程中会产生污染环境的HF及NH3
(4)H2SO4;NH4Cl
(5)通入HCl使AlCl3·6H2O达到饱和,而Al2(SO4)3不饱和
(6)使废弃固体资源化利用
【解析】
试题分析:(1)将固体物质研碎可以增大接触面积,提高浸取速率和浸取率。(2)SiO2不与硫酸反应,CaO与H2SO4反应生的CaSO4的溶解度小,所以第1次过滤时滤渣为SiO2 、CaSO4,; 第3次过滤得Al(OH)3,因为Al(OH)3不溶于氨水;(3)2小时铝的浸出率最高;由图可知在 相同时,浸取率最高的是NH4F; 含氟的化合物在生产过程中会产生污染环境的HF及NH3;(4)由流程图可循环利用的物质有H2SO4、NH4Cl;(5)通入HCl增加Cl-浓度,使平衡向生成AlCl3晶体的方向移动,使AlCl3·6H2O达到饱和,而Al2(SO4)3不饱和。(6)粉煤灰制取含铝化合物可以使废弃固体资源化利用,变废为宝。
相同时,浸取率最高的是NH4F; 含氟的化合物在生产过程中会产生污染环境的HF及NH3;(4)由流程图可循环利用的物质有H2SO4、NH4Cl;(5)通入HCl增加Cl-浓度,使平衡向生成AlCl3晶体的方向移动,使AlCl3·6H2O达到饱和,而Al2(SO4)3不饱和。(6)粉煤灰制取含铝化合物可以使废弃固体资源化利用,变废为宝。
考点:了解化学反应速率和化学平衡的调控在生活、生产和科学研究领域中的重要作用。了解常见化合物的主要性质及应用。了解化学对废旧物资再生与综合利用的作用。


科目:高中化学 来源:2014-2015学年湖南省益阳市高三上学期期中考试化学试卷(解析版) 题型:填空题
(9分)在下列物质转化中,已知A是一种正盐,D的相对分子质量比C的相对分子质量大16,E是酸;当X无论是强酸还是强碱时,都有如下的转化关系:

说明:当X是强酸时A、B、C、D、E均含同一种元素;当X是强碱时,A、B、C、D、E均含另外同一种元素。(已知H2CO3、H2S、H2SO3、H2SiO3皆为二元弱酸)
请回答下列问题:
(1)A是 ,Y是 ,Z是 (填化学式,下同)。
(2)当X是强酸时,E是 ,写出B生成C的化学方程式: _____ 。
(3)当X是强碱时,E是 ,写出D生成E的离子方程式: _____。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省高三12月月考化学试卷(解析版) 题型:选择题
实验表明:将氯水滴加到一张蓝色石蕊试纸上,试纸上会出现如图所示的半径慢慢扩大的内外两个圆环,且两环颜色不同,下列有关说法中不正确的是

A、此实验表明氯水具有酸性、漂白性
B、内环呈白色外环呈红色或浅红色
C、内外环上颜色的差异表明此变化过程中,中和反应比氧化还原反应快
D、氯水中形成次氯酸的反应中还原产物是HClO
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省等五校高三上学期第二次联考理综化学试卷(解析版) 题型:填空题
(15分)二氧化碳是引起“温室效应”的主要物质,节能减排,高效利用能源,能够减少二氧化碳的排放。
(1)在一定温度下的2L固定容积的密闭容器中,通入2 molCO2和3mol H2,发生的反应为:CO2(g)+3H2(g) CH3OH(g)+H2O(g),△H=-a kJ·mol-1(a>0), 测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。

①能说明该反应已达平衡状态的是________。(选填编号)
A.CO2的体积分数在混合气体中保持不变
B.混合气体的平均相对分子质量不随时间的变化而变化
C.单位时间内每消耗1.2mol H2,同时生成0.4molH2O
D.该体系中H2O与CH3OH的物质的量浓度之比为1:1,且保持不变
②计算该温度下此反应的平衡常数K=_________。(保留两位有效数字)。若改变条件 (填选项),可使K=1。
A.增大压强
B.增大反应物浓度
C.降低温度
D.升高温度
E.加入催化剂
(2)某甲醇燃料电池原理如图1所示。

①M区发生反应的电极反应式为_______________________________。
②用上述电池做电源,用图2装置电解饱和食盐水(电极均为惰性电极),则该电解的总反应离子方程式为: 。假设溶液体积为300mL,当溶液的pH值变为13时(在常温下测定),理论上消耗甲醇的质量为______________(忽略溶液体积变化)。
(3)有一种用CO2生产甲醇燃料的方法:
已知:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-a kJ·mol-1;
CH3OH(g)=CH3OH(l) △H=-b kJ·mol-1;
2H2(g)+O2(g)=2H2O(g) △H=-c kJ·mol-1;
H2O(g)=H2O(l) △H=-d kJ·mol-1,
则表示CH3OH(l)燃烧热的热化学方程式为:_____________________________
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省等五校高三上学期第二次联考理综化学试卷(解析版) 题型:选择题
如图所示是298 K时,N2与H2反应过程中能量变化的曲线图,下列叙述错误的是
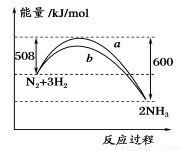
A.加入催化剂,不能改变该化学反应的反应热
B.b曲线是加入催化剂时的能量变化曲线
C.该反应的热化学方程式为:N2(g)+3H2(g)2NH3(g),ΔH=-92 kJ/mol
D.在温度、体积一定的条件下,通入1 mol N2和3 molH2反应后放出的热量为92kJ
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省高三第五次调研考试化学试卷(解析版) 题型:选择题
向某恒容密闭容器中充入一定量C02和H2:,发生反应:
测得平衡体系中C02的百分含量(CO2%)与反应温度变化的关系如图所示。下列物理量中,a点大于b点的是
①正反应速率②逆反应速率③HCOOH(g)的浓度④对应温度时的平衡常数

A.①② B.①③ C.②④ D.③④
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省惠州市高三第三次调研考试化学试卷(解析版) 题型:简答题
(16分)用辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)制备难溶于水的碱式碳酸铜的流程如下:

(1)下列措施是为加快浸取速率,无法达到目的的是__ __
A.延长浸取时间 B.将辉铜矿粉碎
C.充分搅拌 D.适当增加硫酸浓度
(2)浸取反应中氧化剂的化学式为 ;滤渣Ⅰ的成分为MnO2、S和 (写化学式);
(3)研究发现,若先除铁再浸取,浸取速率明显变慢,可能的原因是 。
(4)“除铁”的方法是通过调节溶液PH,使Fe3+水解转化为Fe(OH)3,加入的试剂A可以是_____(化学式);“赶氨”时,最适宜的操作方法 。
(5)“沉锰”(除Mn2+)过程中反应的离子方程式____________ ____ _______ ___。
(6)滤液Ⅱ经蒸发结晶得到的盐主要是 (写化学式)。
查看答案和解析>>
科目:高中化学 来源:2014-2015黑龙江省高二上学期期末考试化学试卷(解析版) 题型:选择题
对下列事实的解释正确的是
A.氯气可以使湿润的有色布条褪色,是因为氯气具有漂白性
B.用氢氟酸雕刻玻璃,是由于氢氟酸能与二氧化硅反应
C.向50mL18mol·L-1 的H2SO4溶液中加入足量的铜片加热充分反应后,被还原的H2SO4的物质的量等于0.45mol
D.常温下,浓硝酸可以用铝制容器贮存,说明铝与浓硝酸不反应
查看答案和解析>>
科目:高中化学 来源:2014-2015学年安徽省安庆五校联盟高三下学期3月联考理综化学试卷(解析版) 题型:填空题
(本题共15分)
氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室制备少量Mg(ClO3)2·6H2O的流程如下:

已知:①卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。
②Mg(ClO3)2、NaClO3 、MgCl2 、NaCl 四种
化合物的溶解度(S)随温度(T)变化曲线如图所示。

(1)加速卤块在KMnO4溶液中溶解的措施有: (写出一点即可)。
(2)加入MgO的作用是 ;过滤后所得滤渣的主要成分为 。
(3)加入NaClO3饱和溶液后发生反应的化学方程式为 ,再进一步制 Mg(ClO3)2·6H2O晶体的实验步骤依次为:①加热蒸发;② ;③ ;④过滤洗涤。
产品中Mg(ClO3)2·6H2O含量的测定:
步骤1:准确称量3.0 g产品配成100 mL溶液。
步骤2:取10.00 mL试液于锥形瓶中,加入10.00 mL稀硫酸和20 .00mL 1.000 mol/L的FeSO4溶液,微热,将Fe2+氧化成Fe3+。
步骤3:冷却至室温,用0.100 mol/L K2Cr2O7 溶液滴定剩余的Fe2+至终点。
此过程中反应的离子方程式为:Cr2O72-+6Fe2++14H+→2Cr3++6Fe3++7H2O。
步骤4:将步骤2、3重复两次
(4)①写出步骤2中发生反应的离子方程式: ;
②步骤3中若滴定前不用标准液润洗滴定管,将会导致最终结果 (填“偏大”、 “偏小”或“不变”);
(5)若平均消耗K2Cr2O7 溶液15.00 mL,则产品中Mg(ClO3)2·6H2O的质量分数为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com