
| A. | Cl-物质的量为0.1mol | B. | Cl-物质的量浓度为0.2 mol•L-1 | ||
| C. | Ba2+物质的量为0.1mol | D. | Ba2+物质的量浓度为0.2 mol•L-1 |
分析 根据n=cV计算出2L0.1mol•L-1 BaCl2溶液中氯化钡的物质的量,从而可知该溶液中含有氯离子和钡离子的物质的量;
氯离子、钡离子的浓度与溶液体积大小无关,根据氯化钡的浓度及化学式组成可计算出氯离子、钡离子的物质的量浓度,据此进行解答.
解答 解:2L 0.1mol•L-1 BaCl2溶液中含有氯化钡的物质的量为:0.1mol/L×2L=0.2mol,
A.0.2mol氯化钡中含有氯离子的物质的量为:0.2mol×2=0.4mol,故A错误;
B.2L0.1mol•L-1 BaCl2溶液中Cl-物质的量浓度为0.1mol/L×2=0.2 mol•L-1,故B正确;
C.0.2mol氯化钡中含有Ba2+物质的量为0.2mol,故C错误;
D.2L0.1mol•L-1 BaCl2溶液中Ba2+物质的量浓度为0.1 mol•L-1,故D错误;
故选B.
点评 本题考查了物质的量浓度的计算,题目难度不大,明确物质的量浓度的概念及表达式为解答关键,试题侧重基础知识的考查,培养了学生的分析能力及化学计算能力.


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:多选题
| A. | 工业上利用电解饱和食盐水制氯气:2H++2Cl-$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑ | |
| B. | 将过量二氧化硫气体通入氨水中:SO2+NH3•H2O═HSO${\;}_{3}^{-}$+NH${\;}_{4}^{+}$ | |
| C. | 用碳酸钠溶液浸泡锅炉水垢:CaSO4+CO${\;}_{3}^{2-}$═CaCO3↓+SO${\;}_{3}^{2-}$ | |
| D. | 用稀硝酸洗涤试管内壁的银镜:3Ag+4H++NO${\;}_{3}^{-}$═3Ag++NO↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 去年12月我国向月球发射的“玉兔号”月亮车,体现了我国航天科技的实力,车上安装的太阳能电池帆板的材料是二氧化硅 | |
| B. | 水泥冶金厂常用高压电除去工厂烟尘,利用了胶体的性质 | |
| C. | 中国食品质量监督局规定,从2011年5月份起,面粉中禁止添加CaO2、过氧化苯甲酰等增白剂,由此说明添加剂均会严重危害人体健康 | |
| D. | 以煤为燃料的工厂、汽车尾气排放物等容易造成雾霾,治理雾霾最好的办法是研制纳米级口罩,以确保肺癌的发病率降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
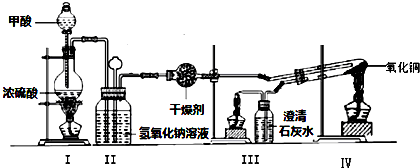
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用KMnO4酸性溶液鉴别乙烯和CO2 | |
| B. | 用pH试纸鉴别NaCl溶液与HCl溶液 | |
| C. | 用观察外观颜色的方法区别铜板和铝板 | |
| D. | 用KOH溶液鉴别Na2CO3和KNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从海水中可提取食盐 | B. | 海水蒸馏可得淡水 | ||
| C. | 直接电解海水可得镁 | D. | 从海水中可提取溴 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
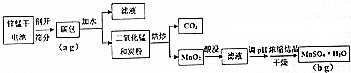
| 酸的种类 | 浓度 | 锌的浸取率/% | 锰的浸取率/% |
| 硫酸 | 1:1 | 96.2 | 95.1 |
| 盐酸 | 1:1 | 95.1 | 94.6 |
| 硝酸 | 1:1 | 94.5 | 94.7 |
| 磷酸 | 1:1 | 58.4 | 42.3 |
| 浓度 | 锌的浸取率/% | 锰的浸取率/% |
| 1:1 | 96.2 | 95.1 |
| 1:2 | 90.4 | 88.5 |
| 1:3 | 87.3 | 82.4 |
| Mn(OH)2 | Al(OH)3 | |||||
| 开始沉淀 | 完全沉淀 | 开始沉淀 | 完全沉淀 | 开始溶解 | 完全溶解 | |
| PH | 8.2 | 9.8 | 3.7 | 5.2 | 7.8 | 10.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com