
| A. | 气体颜色变深 | B. | 气体颜色不变 | C. | 气体颜色变浅 | D. | 先变深后变浅 |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 糖类、油脂和蛋白质均为高分子化合物 | |
| B. | 利用溴的四氯化碳溶液可除去甲烷中的乙烯 | |
| C. | 煤中含有苯、甲苯等,可通过煤的干馏制取 | |
| D. | 苯滴入溴水中振荡后水层接近无色,因为发生了加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1,2-二氯乙烷在NaOH水溶液中加热发生消去反应得到乙炔 | |
| B. | 石油液化气、汽油和石蜡的主要成分都是碳氢化合物 | |
| C. | 除去电石和水反应产生的乙炔中杂质气体,可用稀硫酸洗气 | |
| D. | 由丙烯酸甲酯CH2=CHCOOCH3合成的聚合物为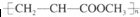 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌是正极,MnO2是负极 | |
| B. | 电解质是KOH溶液 | |
| C. | 锌发生氧化反应,MnO2发生还原反应 | |
| D. | 它的能量和储存时间比普通锌锰电池高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
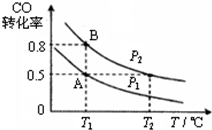 “C1化学”是指以碳单质或分子中含1个碳原子的物质(如CO、CO2、CH4、CH3OH等)为原料合成工业产品的化学工艺,对开发新能源和控制环境污染有重要意义.
“C1化学”是指以碳单质或分子中含1个碳原子的物质(如CO、CO2、CH4、CH3OH等)为原料合成工业产品的化学工艺,对开发新能源和控制环境污染有重要意义.| 容器 编号 | 温度(℃) | 起始的物质的量(mol) | 平衡的物质的量(mol) | |
| CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
| I | 387 | 0.20 | 0.080 | 0.080 |
| Ⅱ | 387 | 0.40 | ||
| Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
| 物质 | CO2 | H2 | CH3OH | H2O |
| 起始投料/mol | 1 | 3 | 2 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定浓度的氨水加水稀释的过程中,c(NH4+)/c(NH3•H2O)的比值增大 | |
| B. | 浓度均为0.1 mol•L-1的Na2CO3、NaHCO3混合溶液中:c(CO32-)>c(HCO3-),且2c(Na+)=3c(H2CO3)+3c(HCO3-)+3c(CO32-) | |
| C. | 常温下0.4 mol•L-1 HB溶液和0.2 mol•L-1 NaOH溶液等体积混合后溶液的pH=3,则溶液中微粒浓度存在下面关系:c(Na+)>c(B-)>c(HB)>c(H+)>c(OH-) | |
| D. | 假设HClO的电离平衡常数为Ka,碳酸的电离常数分别记为:Ka1和Ka2,已知:Ka1>Ka>Ka2,则发生反应:2NaClO+CO2(少量)+H2O═Na2CO3+2HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH | B. | H2SO4 | C. | CH3COONa | D. | KCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com