
已知Na2CO3与盐酸的反应可以看作分两步进行:
Na2CO3+HCl![]() NaCl+NaHCO3
NaCl+NaHCO3
NaHCO3+HCl![]() NaCl+H2O+CO2↑
NaCl+H2O+CO2↑
试讨论:如果将盐酸逐滴加入Na2CO3溶液中与将Na2CO3溶液逐滴加入盐酸中,在实验过程中会出现怎样不同的现象?
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
新型纳米材料氧缺位铁酸盐(MFe2Ox,3<x<4,M=Mn、Co、Zn或Ni)由铁酸盐(MFe2O4)经高温还原而得,常温下,它能使工业废气中的酸性氧化物分解除去。转化流程如图所示:
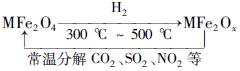
(1)已知铁酸盐(MFe2O4)被H2高温还原时,发生反应的MFe2O4与H2的物质的量之比为2∶1,则还原产物MFe2Ox中x=________,MFe2Ox中+2价铁与+3价铁的物质的量之比为________。
(2)在酸性溶液中,![]() 易转化为Fe2+:
易转化为Fe2+:![]() +2e-+8H+====2Fe2++4H2O,有KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种能使上述还原过程发生,写出该氧化还原反应的离子方程式:_____________________________________。
+2e-+8H+====2Fe2++4H2O,有KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种能使上述还原过程发生,写出该氧化还原反应的离子方程式:_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
新型纳米材料氧缺位铁酸盐(MFe2Ox,3<x<4,M=Mn、Zn、Ni,其均显+2价,下同),由铁酸盐MFe2O4经高温还原得到,常温下,它能使工业废气中的酸性氧化物分解除去,转化流程如下:
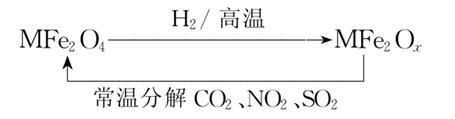
(1)已知铁酸盐(MFe2O4)被H2高温还原时,发生反应的MFe2O4 与H2的物质的量之比为2∶1,则还原产物MFe2Ox中x=________,MFe2Ox中+2价铁与+3价铁的物质的量之比为________。
(2)在酸性溶液中,Fe2O![]() 易转化为Fe2+:
易转化为Fe2+:
Fe2O![]() +2e-+8H+===2Fe2++4H2O
+2e-+8H+===2Fe2++4H2O
有K2MnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种能使上述还原过程发生,写出该氧化还原反应的离子方程式并配平:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
(14分)以工业废铁屑为原料生产氧化铁红颜料并进行适当的综合利用,其主要流程如下:
已知:FeSO4溶液与稍过量的NH4HCO3溶液混合,得到含FeCO3的悬浊液。
请回答下列问题:
(1)用5 % 的Na2CO3热溶液去油污(主要成分是油脂)时,反应生成的有机产物是(写名称): 。
(2)反应Ⅰ需要控制在50 ℃~80 ℃以提高反应速率,如果硫酸过量,反应混合液与空气接触会发生副反应,如何检验副反应的产物?
。
(3)写出在空气中煅烧沉淀的化学反应方程式: 。
(4)本流程中产生的CO2和H2,在催化剂作用下按体积比1∶1合成一种重要的有机化工原料R,该合成符合绿色化学要求。上述合成反应∆H=+14.9 kJ/mol,则加压、降温可以使平衡分别向 、 方向移动。已知液体R的燃烧热为254.6 kJ/mol,则R完全燃烧的热化学方程式为 。
(5)摩尔盐常用于定量分析并用于医药、电镀方面。已知摩尔盐中结晶水的含量为27.6 %,n(Fe2+)∶n(SO2-4 )=1∶2,则摩尔盐的化学式中,结晶水数目x的计算式为:
x= 。
查看答案和解析>>
科目:高中化学 来源:2010年四川省绵阳市高三第三次诊断性考试(理综)化学部分 题型:填空题
(14分)以工业废铁屑为原料生产氧化铁红颜料并进行适当的综合利用,其主要流程如下: 已知:FeSO4溶液与稍过量的NH4HCO3溶液混合,得到含FeCO3的悬浊液。
已知:FeSO4溶液与稍过量的NH4HCO3溶液混合,得到含FeCO3的悬浊液。


请回答下列问题:
(1)用5 % 的Na2CO3热溶液去油污(主要成分是油脂)时,反应生成的有机产物是(写名称): 。
(2)反应Ⅰ需要控制在50 ℃~80 ℃以提高反应速率,如果硫酸过量,反应混合液与空气接触会发生副反应,如何检验副反应的产物?
。
(3)写出在空气中煅烧沉淀的化学反应方程式: 。
(4)本流程中产生的CO2和H2,在催化剂作用下按体积比1∶1合成一种重要的有机化工原料R,该合成符合绿色化学要求。上述合成反应?H=+14.9 kJ/mol,则加压、降温可以使平衡分别向 、 方向移动。已知液体R的燃烧热为254.6 kJ/mol,则R完全燃烧的热化学方程式为 。
(5)摩尔盐常用于定量分析并用于医药、电镀方面。已知摩尔盐中结晶水的含量为27.6 %,n(Fe2+)∶n(SO2-4 )=1∶2,则摩尔盐的化学式中,结晶水数目x的计算式为:
x= 。
查看答案和解析>>
科目:高中化学 来源:2010年四川省绵阳市高三第三次诊断性考试(理综)化学部分 题型:填空题
(14分)以工业废铁屑为原料生产氧化铁红颜料并进行适当的综合利用,其主要流程如下:
 已知:FeSO4溶液与稍过量的NH4HCO3溶液混合,得到含FeCO3的悬浊液。
已知:FeSO4溶液与稍过量的NH4HCO3溶液混合,得到含FeCO3的悬浊液。
请回答下列问题:
(1)用5 % 的Na2CO3热溶液去油污(主要成分是油脂)时,反应生成的有机产物是(写名称): 。
(2)反应Ⅰ需要控制在50 ℃~80 ℃以提高反应速率,如果硫酸过量,反应混合液与空气接触会发生副反应,如何检验副反应的产物?
。
(3)写出在空气中煅烧沉淀的化学反应方程式: 。
(4)本流程中产生的CO2和H2,在催化剂作用下按体积比1∶1合成一种重要的有机化工原料R,该合成符合绿色化学要求。上述合成反应∆H=+14.9 kJ/mol,则加压、降温可以使平衡分别向 、 方向移动。已知液体R的燃烧热为254.6 kJ/mol,则R完全燃烧的热化学方程式为 。
(5)摩尔盐常用于定量分析并用于医药、电镀方面。已知摩尔盐中结晶水的含量为27.6 %,n(Fe2+)∶n(SO2-4 )=1∶2,则摩尔盐的化学式中,结晶水数目x的计算式为:
x= 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com