
【题目】下列叙述不正确的是( )
A. CCl4可由CH4制得,可萃取碘水中的碘
B. 乙烯和甲苯分子中所有原子都在同一个平面上
C. 煤油可由石油分馏获得,可用作燃料和保存少量金属钠
D. ![]() 和CH3-CH=CH2互为同分异构体
和CH3-CH=CH2互为同分异构体
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】氯化铁是黑棕色晶体,沸点为315℃,有强烈的吸水性,易潮解。某小组同学对无水FeCl3能否分解产生Cl2,进行了如下实验探究。
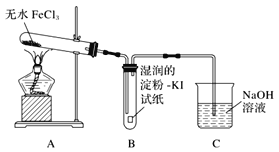
(1)甲同学认为装置B中湿润的淀粉KI试纸变蓝即可证明无水FeCl3能分解产生Cl2,乙同学认为不能得出此结论,理由是_______。
(2)乙同学提出了改进意见,用如图所示装置进行实验:
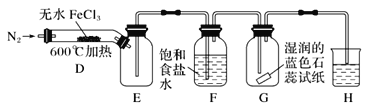
装置H中的试剂为________。装置F中饱和食盐水的作用是________。实验结束后,取装置D中残留固体溶于稀盐酸中,向所得溶液中加入_________(填化学式)溶液,若观察到_____,说明FeCl3已经分解完全。
(3)实验后把镁条投入装置F的溶液中,发生的现象是___,其原因是(结合离子方程式)解释_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以铬铁矿(主要成分为FeO·Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7·2H2O),其主要反应为:
⑴4FeO·Cr2O3+8Na2CO3+7O2 ![]() 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
⑵2Na2CrO4+H2SO4![]() Na2SO4+Na2Cr2O7+H2O
Na2SO4+Na2Cr2O7+H2O
下列说法中正确的是
A.反应⑴和⑵均为氧化还原反应
B.反应⑴的氧化剂是O2,还原剂是FeO·Cr2O3
C.高温下,O2的氧化性大于Fe2O3小于Na2CrO4
D.生成1mol的Na2Cr2O7时共转移7mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】世界水产养殖协会网介绍了一种利用电化学原理净化鱼池中水质的方法,其装置如图所示。下列说法正确的是
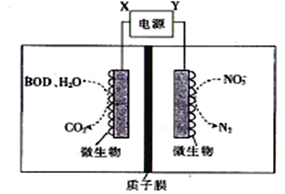
A. X为电源负极
B. 若该装置在高温下进行,则净化效率将降低
C. 若有1molNO3-被还原,则有6molH+通过质子膜迁移至阴极区
D. 若BOD为葡萄糖(C6H12O6),则1mol葡萄糖被完全氧化时,理论上电极流出20 mol e-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大豆中含有丰富的蛋白质、脂肪等营养物质,由大豆加工出来的食品很多,深受人们喜爱。请回答下列问题:
(1)我们所吃的豆腐的主要成分是________(填写字母)。
A.凝胶 B.蛋白质 C.脂肪 D.淀粉
(2)点豆腐所采用的凝聚剂是________(填写字母)。
A.石膏 B.硫酸钡 C.氢氧化钠 D.硫酸
(3)我们食用的大豆,最终补充给人体的主要成分是________(填写字母)。
A.氨基酸 B.蛋白质 C.多肽 D.糖类
(4)大豆中含有一定量的酯类。该液态酯类的水解产物是丙三醇(俗称________)和________,其分子结构中________(填“有”或“无”)碳碳双键,丙三醇的结构简式是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用氧化铝基废催化剂(主要成分为Al2O3,还含有少量Pd)回收Al2(SO4)3及Pd的流程如下:

(1)Al2(SO4)3溶液蒸干灼烧后所得物质的化学名称是___________。
(2)焙烧时Al2O3与(NH4)2SO4反应的化学方程式为___________。
水浸与中和步骤得到溶液的操作方法是___________。
(3)浸液Y中含Pd元素的溶质是___________ (填化学式)。
(4)“热还原”中每生成1molPd生成的气体的物质的量为___________ (已知热还原得到的固体只有Pd)。
(5)Pd是优良的储氢金属,其储氢原理为2Pd(s)+xH2(g)==2PdHx(s),其中x的最大值为0.8。已知: Pd的密度为12g·cm-3, 则10.6cm3Pd能储存标准状况下H2的最大体积为___________L。
(6)铝的阳极氧化法是将铝作为阳极,置于硫酸等电解液中,加入α-羟基丙酸、丙三醇后进行电解,可观察到铝的表面会形成一层致密的氧化膜。
①写出电解时阳极的电极反应式:______________________ 。
②电解过程中α-羟基丙酸、丙三醇的作用可能是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能,此时硫酸铅电极处生成Pb。下列有关说法正确的是
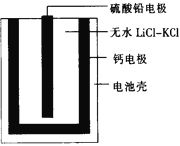
A. 输出电能时,外电路中的电子由硫酸铅电极流向钙电极
B. 放电时电解质LiCl-KCl中的Li+向钙电极区迁移
C. 电池总反应为Ca+PbSO4+2LiCl![]() Pb+Li2SO4+CaCl2
Pb+Li2SO4+CaCl2
D. 每转移0.2 mol电子,理论上消耗42.5 g LiCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业含铬(Ⅵ)污水能污染水源,被人体吸收后易积累而导致器官癌变,必须经无害化处理后才能排放。青岛某污水处理厂的工艺流程如图:
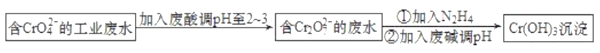
回答下列问题:
(1)CrO42-氧化性较弱,酸性条件下转化为具有较强氧化性的Cr2O72-的离子方程式为__。
(2)已知N2H4与Cr2O72-反应生成无毒气体。若要处理Cr2O72-浓度为0.01mol·L-1的废水1m3,至少需要加入N2H4__kg。
(3)含有SO32-的废水可以代替N2H4处理酸性含铬(Ⅵ)废水,用离子方程式表示其反应原理__。
(4)Cr(OH)3的化学性质与Al(OH)3相似。上述流程中“②加入废碱调pH”时要控制溶液的pH不能过高,原因是__。
(5)含铬(Ⅵ)污水也可用电解法处理。用铁和石墨作电极电解污水,Cr2O72-在阳极区转化为Cr3+,随着电解的进行,溶液pH逐渐增大,Cr3+转化为Cr(OH)3沉淀除去。
①该电解装置中用___作阳极,阳极区除生成Cr(OH)3外还有_沉淀(写化学式)。
②阴极电极反应式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯胺![]() 是重要的化工原料。某兴趣小组在实验室里进行苯胺的相关实验。
是重要的化工原料。某兴趣小组在实验室里进行苯胺的相关实验。
已知:①![]() 和NH3相似,与盐酸反应生成易溶于水的盐
和NH3相似,与盐酸反应生成易溶于水的盐![]()
②用硝基苯制取苯胺的反应原理: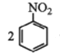 +3Sn+12HCl
+3Sn+12HCl![]()
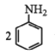 +3SnCl4+4H2O
+3SnCl4+4H2O
③有关物质的部分物理性质见下表:
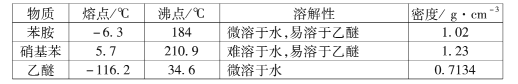
I.比较苯胺与氨气的性质
(1)将分别蘸有浓氨水和浓盐酸的玻璃棒靠近,产生白烟,反应的化学方程式为____;用苯胺代替浓氨水重复上述实验,却观察不到白烟,原因是____。
Ⅱ.制备苯胺
往图1所示装置(夹持装置略,下同)的冷凝管口分批加入20mL浓盐酸(过量),置于热水浴中回流20min,使硝基苯充分还原;冷却后,往三颈烧瓶中滴入一定量50% NaOH溶液,至溶液呈碱性。

(2)冷凝管的进水口是____(填“a”或“b”);
(3)滴加NaOH溶液的主要目的是析出苯胺,反应的离子方程式为____。
Ⅲ.提取苯胺
i.取出图1所示装置中的三颈烧瓶,改装为图2所示装置。加热装置A产生水蒸气,烧瓶C中收集到苯胺与水的混合物;分离混合物得到粗苯胺和水溶液。

ii.往所得水溶液中加入氯化钠固体,使溶液达到饱和状态,再用乙醚萃取,得到乙醚萃取液。
iii.合并粗苯胺和乙醚萃取液,用NaOH固体干燥,蒸馏后得到苯胺2.79g。
(4)装置B无需用到温度计,理由是____。
(5)操作i中,为了分离混合物,取出烧瓶C前,应先打开止水夹d,再停止加热,理由是____。
(6)该实验中苯胺的产率为____。
(7)欲在不加热条件下除去苯胺中的少量硝基苯杂质,简述实验方案:____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com