
下列有关原子结构和元素周期律的表述正确的是…( )
①原子序数为15的元素的最高化合价为+3 ②ⅦA族元素是同周期中非金属性最强的元素 ③第二周期ⅣA族元素的原子核电荷数和中子数一定为6 ④原子序数为12的元素位于元素周期表的第三周期ⅡA族
A.①② B.①③ C.②④ D.③④
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
[化学——物质结构与性质](13分)
氮化硼(BN)晶体有多种相结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂。立方相氮化硼是超硬材料,有优异的耐磨性。它们的晶体结构如下图所示。
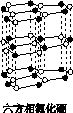
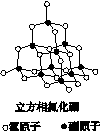
(1)基态硼原子的电子排布式为________。
(2)关于这两种晶体的说法,正确的是________(填序号)。
a.立方相氮化硼含有σ键和π键,所以硬度大
b.六方相氮化硼层间作用力小,所以质地软
c.两种晶体中的B—N键均为共价键
d.两种晶体均为分子晶体
(3)六方相氮化硼晶体层内一个硼原子与相邻氮原子构成的空间构型为________,其结构与石墨相似却不导电,原因是_____________________________________________________。
(4)立方相氮化硼晶体中,硼原子的杂化轨道类型为________。该晶体的天然矿物在青藏高原地下约300 km的古地壳中被发现。根椐这一矿物形成事实,推断实验室由六方相氮化硼合成立方相氮化硼需要的条件应是________________。
(5)NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一。1 mol NH4BF4 含有________mol配位键。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料。下列说法正确的是
A.元素A、B组成的化合物常温下一定呈气态
B.一定条件下,元素C、D的最高价氧化物对应的水化物之间能发生反应
C.工业上常用电解法制备元素C、D、E的单质
D.化合物AE与CE古有相同类型的化学键
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,完全分解下列某化合物2 g,产生氧气1.6 g,此化合物是( )
A.1H216O B.2H216O C.1H218O D.2H218O
查看答案和解析>>
科目:高中化学 来源: 题型:
已知X、Y、Z三种元素组成的化合物是离子晶体,其晶胞如图所示,则下面表示该化合物的化学式正确的是
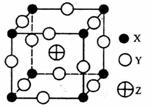
A.ZXY3 B.ZX2Y6 C.ZX4Y8 D.ZX8Y12
查看答案和解析>>
科目:高中化学 来源: 题型:
氮是地球上极为丰富的元素。
(1)Li3N晶体中氮以N3-存在,基态N3-的电子排布式为 。
(2)N≡N的键能为942 kJ·mol-1,N-N单键的键能为247 kJ·mol-1。计算说明N2中的 键比 键稳定(填“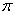 ”或“
”或“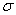 ”)。
”)。
(3)(CH3)3NH+和AlCl4可形成离子液体。离子液体由阴、 阳离子组成,熔点低于100℃,其挥发性一般比有机溶剂 (填“大”或“小”),可用作 (填代号)。
阳离子组成,熔点低于100℃,其挥发性一般比有机溶剂 (填“大”或“小”),可用作 (填代号)。
a. 助燃剂
b.“绿色”溶剂
c. 复合材料
d. 绝热材料
(4)X+中所有电子正好充满K、L、M三个电子层,它与N3-形成的晶体结构如图所示。X的元素符号是 ,与同一个N3-相连的X+有 个。
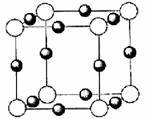
查看答案和解析>>
科目:高中化学 来源: 题型:
32S与33S互为同位素,下列说法正确的是
A.32S与33S原子的最外层电子数均为2
B.32S与33S具有相同的中子数
C.32S与33S具有不同的电子数
D.32S与33S具有相同的质子数
查看答案和解析>>
科目:高中化学 来源: 题型:
C、Si、Ge、Sn是同族元素,该族元素单质及其化合物在材料、医药等方面有重要应用。请回答下列问题:
(1)Ge的原子核外电子排布式为
(2)C、Si、Sn三种元素的单质中,能够形成金属晶体的是
(3)按要求指出下列氧化物的空间构型、成键方式或性质
①CO2分子的空间构型及碳氧之间的成键方式 ;
②SiO2晶体的空间构型及硅氧之间的成键方式 ;
③已知SnO2是离子晶体,写出其主要物理性质 (写出2条即可)
CO可以和很多金属形成配合物,如Ni(CO)4,Ni与CO之间的键型为
(4)碳氧键的红外伸缩振动频率与键的强度成正比,已知Ni(CO)4中碳氧键的伸缩振动频率为2060cm-1,CO分子中碳氧键的伸缩振动频率为2143cm-1,则Ni(CO)4中碳氧键的强度比CO分子中碳氧键的强度 (填字母)
A 强 B 弱 C 相等 D 无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
固体硝酸盐加热易分解且产物较复杂。某学习小组以Mg(NO3)2为研究对象,拟通过实验探究其热分解的产物,提出如下4种猜想,其中不成立的是
A.Mg(NO3)2、NO2、O2 B.MgO、NO2、O2
C.Mg3N2、O2 D.MgO、NO2、N2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com