
| A. | NH3•H2O | B. | HCl | C. | H2SO4 | D. | CO2 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:选择题
| A. | $\frac{a-b}{a}$ | B. | $\frac{a}{a+b}$ | C. | $\frac{2a-b}{a}$ | D. | $\frac{2a-b}{b}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (Ⅰ)一研究性学习小组对某工业城市的空气污染进行了下列研究.
(Ⅰ)一研究性学习小组对某工业城市的空气污染进行了下列研究.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,Na2O2与足量H2O反应,共生成0.2molO2,转移电子的数目为0.8NA | |
| B. | 25℃,pH=13的NaOH溶液中含有OH-的数目为0.1NA | |
| C. | 1mol甲基(-14C1H3)所含的中子数和电子数分别为8NA、9NA | |
| D. | 含4molHCl的浓盐酸与足量的二氧化锰在加热条件下反应,一定能产生NA个Cl2气体分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | A | B | C | D |
| 实验 | 除去氯化钠晶体中混有的氯化铵晶体 | 分离CCl4中的I2 | 分离酒精和水 | 除去CO气体中的CO2气体 |
| 装置 | 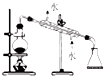 |  |  |  |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用结晶的方法分离氯化钠和硝酸钾的混合物 | |
| B. | 将液态物质加热至沸点,使之汽化,再重新冷凝为液体的操作过程称为蒸发 | |
| C. | 用分液的方法分离酒精和水的混合物 | |
| D. | 做焰色反应后,铂丝用稀硫酸洗涤,然后再放在火焰上灼烧至无色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com