
【题目】已知最外层电子数相等的元素原子具有相似的化学性质。下列原子中,与氧元素原子的化学性质相似的是( )
A.NeB.MgC.SD.C
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】甲、乙、丙三种物质是某抗生素合成过程中的中间产物,下列说法不正确的是

A. 甲分子苯环上的一氯代物有两种
B. 乙、丙均可与NaOH溶液发生反应
C. 乙分子中所有碳原子可能位于同一个平面
D. 甲、乙、丙三种有机化合物都能发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,A是由X和Y两种短周期元素组成的气体,X的原子序数小于Y,甲、乙、丙分别是X、Y、Z元素对应的单质,Z是地壳中含量最高的元素,它们有如右图所示的转化关系。下列说法不正确的是

A. X、Y、Z三种元素能组成离子化合物
B. 反应②为化合反应,反应③为置换反应
C. 常温常压下,Z的简单氢化物的熔沸点为同族最高
D. 原子半径:Y>Z>X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是来自石油的重要有机化工原料,此物质可以用来衡量一个国家石油化工发展水平。E是具有果香味的有机物,D能与碳酸钠反应产生气体,F是一种高聚物,可制成多种包装材料。
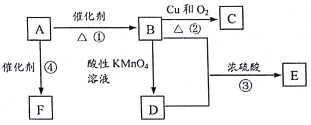
(1)A的结构式为___________。
(2)C分子中的官能团名称是_________,验证C物质存在该官能团的试剂是__________,现象为_________________________。
(3)写出下列反应的化学方程式并指出反应类型:
①____________________________:反应类型是______________;
③____________________________;反应类型是______________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】菠萝酯是一种有菠萝香气的食用香料,是化合物甲与苯氧乙酸发生酯化反应的产物。苯氧乙酸的结构简式为:![]() 。
。
(1)甲一定含有的官能团的名称是_________。
(2)5.8g甲完全燃烧可产生0.3molCO2和0.3molH2O。甲蒸气对氢气的相对密度是29,甲分子中不含甲基,且为链状结构,则甲的结构简式是_________________。
(3)苯氧乙酸有多种酯类的同分异构体,其中能与三氯化铁溶液发生显色反应,且苯环上有2种一硝基取代物的同分异构体是(写出任意2种的结构简式)_________________。
(4)已知:RCH2COOH![]() RCHClCOOH
RCHClCOOH
R-ONa![]() R-O-Rˊ(R-、Rˊ-代表烃基)
R-O-Rˊ(R-、Rˊ-代表烃基)
菠萝酯的合成路线如下:
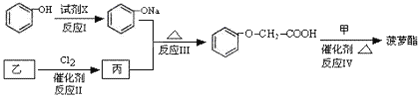
①试剂X不可选用的是(选填字母)_________。
A.CH3COONa溶液 B.NaOH溶液
C.NaHCO3溶液 D.Na
②丙的结构简式是_____________,反应Ⅱ的反应类型是________________。
③反应的Ⅳ的化学方程式是_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学结合所学知识探究Na2O2与H2能否反应,设计装置如下,下列说法正确的是

A. 装置A气密性的检查方法:直接向长颈漏斗中加水,当漏斗中液面高于试管中液面且高度不变说明气密性良好
B. 装置B中盛放硅胶,目的是除去A中挥发出来的少量水蒸气
C. 装置C加热前,用试管在干燥管管口处收集气体点燃,通过声音判断气体纯度
D. 装置A也可直接用于Cu与浓硫酸反应制取SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。其反应原理如下: 电池: Pb(s) + PbO2(s) + 2H2SO4(aq) =2PbSO4(s) + 2H2O(l);
电解池:2Al+3O2![]() Al2O3+3H2↑电解过程中,以下判断正确的是( )
Al2O3+3H2↑电解过程中,以下判断正确的是( )
电池 | 电解池 | |
A | H+移向Pb电极 | H+移向Pb电极 |
B | 每消耗3molPb | 生成2molAl2O3 |
C | 正极:PbO2+4H++2e—=Pb2++2H2O | 阳极:2Al+3H2O-6e—=Al2O3+6H+ |
D |
|
|
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在日常生活、生产中应用广泛,研究铁及其化合物的应用意义重大。试回答下列问题:
(1)已知:高炉炼铁过程中会发生如下反应:
①FeO(s)+CO(g)===Fe(s)+CO2(g) ΔH1
②3Fe2O3(s)+CO(g)===2Fe3O4(s)+CO2(g) ΔH2
③Fe3O4(s)+CO(g)===3FeO(s)+CO2(g) ΔH3
则反应Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g)的ΔH的表达式为_______________________________(用含ΔH1、ΔH2、ΔH3的代数式表示)。
(2)上述反应在高炉中大致分为三个阶段,各阶段主要成分与温度的关系如下表:
温度/℃ | 250 | 600 | 1000 | 2000 |
主要成分 | Fe2O3 | Fe3O4 | FeO | Fe |
1600 ℃时固体物质的主要成分为_____________(填化学式);若该温度下,测得固体混合物中m(Fe)∶m(O)=35∶4,则FeO被CO还原为Fe的百分率为______________(设其他固体杂质中不含Fe、O元素)。
(3)铁的某些化合物可用作CO与H2反应的催化剂。已知某种铁的化合物可用来催化反应:CO(g) + 3H2(g)![]() CH4(g) + H2O(g) ΔH <0 。
CH4(g) + H2O(g) ΔH <0 。
在T ℃、a MPa时,将2 mol CO和6 mol H2充入某容积可变的密闭容器中,实验测得CO的物质的量在反应体系中所占百分比x(CO)如下表:
t/min | 0 | 10 | 20 | 30 | 40 | 50 |
x(CO) | 0.25 | 0.23 | 0.21 | 0.20 | 0.10 | 0.10 |
① T ℃ a MPa时,此反应的平衡常数K = ____________(保留1位小数)。达到平衡时CO的转化率为___________。

②上图表示该反应CO的平衡转化率与温度、压强的关系。
图中温度T1、T2、T3由低到高的顺序是________________。图中显示其它条件固定时,增加压强会导致平衡向___________(填“左”或“右”)移动。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com