
分析 反应中Mn元素的化合价降低,则R元素的化合价升高,0.2m olRxO42-离子参加反应时,共转移0.4mol电子,则0.2mol×2×(4-$\frac{6}{x}$)=0.4,结合电子、电荷守恒解答.
解答 解:(1)Mn元素的化合价降低,则R失去电子被氧化,对应氧化产物为RO2,故答案为:RO2;
(2)0.2m olRxO42-离子参加反应时,共转移0.4mol电子,则0.2mol×2×(4-$\frac{6}{x}$)=0.4,解得x=2,故答案为:2;
(3)由电子、电荷守恒可知,离子反应为5R2O42-+2MnO4-+16H+=10RO2+2Mn2++8H2O,故答案为:5R2O42-+2MnO4-+16H+=10RO2+2Mn2++8H2O.
点评 本题考查氧化还原反应及计算,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意电子、电荷守恒的应用,题目难度不大.


科目:高中化学 来源: 题型:解答题
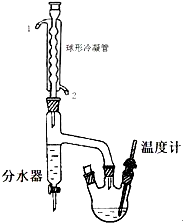 正丁醚是惰性溶剂,可用作有机合成反应溶剂.某实验小组利用如下装置(夹持和加热装置均省略)合成正丁醚.发生的反应为:
正丁醚是惰性溶剂,可用作有机合成反应溶剂.某实验小组利用如下装置(夹持和加热装置均省略)合成正丁醚.发生的反应为:| 化合物名称 | 密度(g/mL) | 熔点(℃) | 沸点(℃) | 水中溶解性 |
| 正丁醇 | 0.810 | -89.8 | 118.0 | 微溶 |
| 正丁醚 | 0.7689 | -95.3 | 142 | 不溶于水 |
| 备注:正丁醚微溶于饱和氯化钙溶液. | ||||
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可使用填埋法处理未经分类的生活垃圾 | |
| B. | 光化学烟雾的形成与汽车尾气中的氮氧化物有关 | |
| C. | 光导纤维都是有机高分子化合物 | |
| D. | “鸟巢”使用钒氮合金钢,该合金熔点、硬度和强度均比纯铁高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
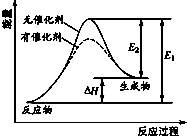
| A. | 该反应为放热反应 | |
| B. | 催化剂能降低该反应的焓变 | |
| C. | 催化剂能降低E2的值 | |
| D. | 逆反应的活化能大于正反应的活化能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{{m}^{2}}{n}$ | B. | $\frac{{m}^{2}}{m+n}$ | C. | $\frac{{m}^{2}}{n-m}$ | D. | $\frac{{n}^{2}}{{m}^{3}}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 125 mL | B. | 275 mL | C. | 325 mL | D. | 450 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 萃取溴水中的溴,将四氯化碳和溴水混合后,振荡并打开分液漏斗瓶塞,使漏斗内气体放出 | |
| B. | 在蔗糖中加入浓硫酸时,蔗糖变黑,证明浓硫酸具有脱水性 | |
| C. | 向Ba(NO3)2溶液中通入SO2气体,产生白色沉淀,可推测SO2与可溶性钡盐均能反应产生白色沉淀 | |
| D. | 若要检验铜和浓硫酸反应后产物硫酸铜,可向反应后的试管中加入少量水,观察溶液是否变蓝,若变蓝则证明有硫酸铜生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22 | B. | 24 | C. | 20 | D. | 25 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验 序号 | 锌的质量/g | 锌的 状态 | c(H2SO4)/mol•L-1 | V(H2SO4)/mL | 反应前溶液的温度/℃ | 添加剂 |
| 1 | 0.65 | 粉状 | 0.5 | 50 | 20 | 无 |
| 2 | 0.65 | 粉末 | 0.5 | 50 | 20 | 无 |
| 3 | 0.65 | 粉状 | 0.5 | 50 | 20 | 2滴CuSO4溶液 |
| 4 | 0.65 | 粉末 | 0.8 | 50 | 20 | 无 |
| 5 | 0.65 | 粉末 | 0.8 | 50 | 35 | 2滴CuSO4溶液 |
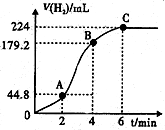
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com