
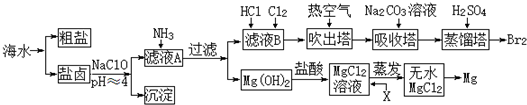
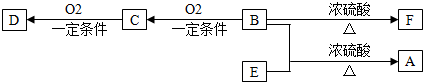
分析 海水晒盐得到粗盐和盐卤,盐卤中含有Na+、Mg2+、Fe2+、Fe3+、Cl-、Br-等离子,加入NaClO氧化亚铁离子,调节溶液PH使铁离子全部沉淀,过滤得到滤液A中加入氨气沉淀镁离子,过滤得到滤液B和氢氧化镁沉淀,氢氧化镁加入盐酸溶解得到氯化镁溶液,通过蒸发浓缩,冷却结晶得到氯化镁晶体,加入盐酸抑制镁离子的水解,加热得到氯化镁固体,电解得到金属镁,滤液B通入氯化氢和氯气,氧化溴离子为溴单质,在吹出塔中通入热的空气得到溴蒸气.在吸收塔中加入碳酸钠溶液吸收溴单质,吸收塔中溴以Br-和BrO3-的形式存在,在蒸馏塔中加入硫酸使Br-和BrO3-在酸溶液中发生氧化还原反应得到溴单质;
(1)电解饱和食盐水生成氢氧化钠、氯气和氢气;
(2)①盐卤中含有弱碱阳离子铁离子、亚铁离子等水解溶液呈酸性;
②加入NaClO的目的是将Fe2+氧化成Fe3+,便于除去铁离子;
(3)为抑制镁离子水解,制备无水MgCl2时需持续加入盐酸;
(4)若吸收塔中溴以Br-和BrO3-的形式存在,依据电子守恒计算得到n(Br-):n(BrO3-);
(5)在蒸馏塔中加入硫酸使Br-和BrO3-在酸溶液中发生氧化还原反应得到溴单质,加入硫酸是难挥发性酸,盐酸是易挥发性酸;
解答 解:海水晒盐得到粗盐和盐卤,盐卤中含有Na+、Mg2+、Fe2+、Fe3+、Cl-、Br-等离子,加入NaClO氧化亚铁离子,调节溶液PH使铁离子全部沉淀,过滤得到滤液A中加入氨气沉淀镁离子,过滤得到滤液B和氢氧化镁沉淀,氢氧化镁加入盐酸溶解得到氯化镁溶液,通过蒸发浓缩,冷却结晶得到氯化镁晶体,加入盐酸抑制镁离子的水解,加热得到氯化镁固体,电解得到金属镁,滤液B通入氯化氢和氯气,氧化溴离子为溴单质,在吹出塔中通入热的空气得到溴蒸气.在吸收塔中加入碳酸钠溶液吸收溴单质,吸收塔中溴以Br-和BrO3-的形式存在,在蒸馏塔中加入硫酸使Br-和BrO3-在酸溶液中发生氧化还原反应得到溴单质;
(1)电解饱和食盐水生成氢氧化钠、氯气和氢气,反应的离子方程式为:2Cl-+2H2O $\frac{\underline{\;电解\;}}{\;}$ Cl2↑+H2↑+2OH-,
故答案为:2Cl-+2H2O $\frac{\underline{\;电解\;}}{\;}$ Cl2↑+H2↑+2OH-;
(2)①盐卤中含有弱碱阳离子铁离子、亚铁离子等水解溶液呈酸性,
故答案为:酸性;
②加入NaClO的目的是将Fe2+氧化成Fe3+,便于除去铁离子,
故答案为:将Fe2+氧化成Fe3+,同时调pH使Fe3+全部沉淀;
(3)溶液中镁离子水解,Mg2++2H2O=Mg(OH)2+2H+,为抑制镁离子水解,制备无水MgCl2时需持续加入的X为盐酸,
故答案为:盐酸,Mg2++2H2O=Mg(OH)2+2H+;
(4)若吸收塔中溴以Br-和BrO3-的形式存在,溴单质在碱溶液中发生歧化反应,0价变化为+5价和-1价,依据电子守恒计算得到,n(Br-):n(BrO3-)=5:1,
故答案为:5:1;
(5)在蒸馏塔中加入硫酸使Br-和BrO3-在酸溶液中发生氧化还原反应得到溴单质,反应的离子方程式为:5Br-+BrO3-+6H+=3Br2+3H2O,氯离子能被氧化,而硫酸根离子不被氧化;
故答案为:5Br-+BrO3-+6H+=3Br2+3H2O;氯离子能被氧化而硫酸根离子不被氧化.
点评 本题考查了海水资源的应用,物质提纯方法和步骤分析判断,主要是海水提溴、海水提镁的生产流程分析应用,掌握基础是关键,提镁难度中等.


科目:高中化学 来源:2016-2017学年河南省高一上月考二化学试卷(解析版) 题型:选择题
若20 g密度为ρ g·cm-3的Ca(NO3)2(相对分子质量为164)溶液中含有1 g Ca(NO3)2,则溶液中NO 的物质的量浓度为( )
的物质的量浓度为( )
A.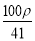 mol·L-1 B.
mol·L-1 B.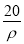 mol·L-1 C.
mol·L-1 C.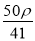 mol·L-1 D.
mol·L-1 D.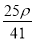 mol·L-1
mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 结构片段为 的高聚物,其单体是甲醛和苯酚 的高聚物,其单体是甲醛和苯酚 | |
| B. | 等质量的乙烯、乙醇、丙烯酸(CH2=CH-COOH)完全燃烧消耗氧气的量相等 | |
| C. | 由甘氨酸、丙氨酸形成的二肽有三种 | |
| D. | 石油的裂化、煤的汽化与液化都属于化学变化,而石油的分馏与煤的干馏都属于物理变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铜及其化台物在工业、农业、科技和日常生活中有广泛应用.
铜及其化台物在工业、农业、科技和日常生活中有广泛应用.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O+2F2═4HF+O2 | B. | H2O+3NO2═2HNO3+NO | ||
| C. | 3H2O+P2O5═2H3PO4 | D. | H2O+Si+2NaOH═2H2↑+Na2SiO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高温、高压、催化剂条件下,1 mol N2与足量H2充分反应转移的电子数为6 NA | |
| B. | 将NO2和NO混合,标准状况下,22.4 L混合气体中所含的氮原子总数为2 NA | |
| C. | 常温下,10 L pH=12的Na2CO3溶液中含有的OH-离子数为0.1NA | |
| D. | 将含有1molFeCl3的浓溶液完全水解可得到Fe(OH)3胶粒的数目为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com