
| A. | 不溶物一定是铜 | B. | 不溶物一定是铁 | ||
| C. | 不溶物中一定含铜,但不一定含铁 | D. | 滤液中可能含有CuSO4 |
分析 先根据金属的活泼性判断反应的金属,金属活动性由强到弱的顺序:铁>氢>铜,氧化铜和铁粉的混合物中加入一定量的稀硫酸,氧化铜和硫酸反应生成硫酸铜和水,铁与硫酸生成硫酸亚铁和氢气,铁与硫酸铜反应生成铜和硫酸亚铁,然后根据题意判断哪种物质不足量或恰好反应,从而确定不溶物的成分.
解答 解:金属活动性由强到弱的顺序:铁>氢>铜,往CuO和铁粉的混合物中,加入一定量的稀H2SO4,并微热,铁和稀硫酸反应生成硫酸亚铁,氧化铜和稀硫酸反应生成硫酸铜,铁与硫酸铜反应生成铜,所以不溶物中一定有铜;根据“滤出不溶物,并向滤液中插入一枚铁钉,发现铁钉并无任何变化”,稀硫酸和铜离子都完全反应,铁的反应情况有两种:一种是恰好反应,所以不溶物是铜;一种是铁过量,所以不溶物是铁和铜,
故选C.
点评 本题以氧化铜和铁与稀硫酸的反应为载体,考查了金属活动性顺序的应用,完成此题,可以依据金属活动性顺序以及离子之间的反应分析,题目难度不大.


科目:高中化学 来源: 题型:解答题
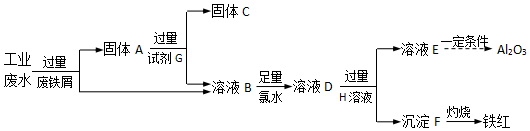
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 分类 | 名称(或俗名) | 化学式 | |
| A | 碱性氧化物 | 铁红 | FeO |
| B | 碱性氧化物 | 刚玉 | Al2O3 |
| C | 酸 | 硫酸 | H2S |
| D | 盐 | 纯碱 | Na2CO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 烧碱、纯碱、熟石灰都是碱 | B. | 铝土矿、水玻璃、小苏打都是混合物 | ||
| C. | Na2O、Al2O3、Fe2O3都是碱性氧化物 | D. | H2SO4、KOH、NaCl都是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用石墨棒做电极电解氯化铜溶液,与负极相连的石墨棒上有气泡产生 | |
| B. | 氢氧燃料电池工作时氢气在负极被氧化 | |
| C. | 铅蓄电池充电时,PbSO4仅在负极生成 | |
| D. | 红热的铁丝与冷水接触,表面形成蓝黑色保护层,这种变化属于原电池反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 催化剂是影响化学反应速率的本质因素 | |
| B. | 当反应体系容积不变时,减小反应物的量肯定能降低反应速率 | |
| C. | 可逆反应达到反应限度时,化学反应速率为0 | |
| D. | 化学反应速率可用单位时间内反应物的浓度变化量来表示 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 洗净的检验是检验最后一次洗涤液中是否含有形成沉淀的该溶液中的离子 | |
| B. | 洗涤的试剂一般可选用蒸馏水、冰水、乙醇、该物质的饱和溶液 | |
| C. | 洗涤的目的一般是除去沉淀或晶体表面可溶性的杂质,提高纯度 | |
| D. | 洗涤的操作是向过滤器里加洗涤剂,一般洗涤剂尽量多加,然后让洗涤剂自然流下 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
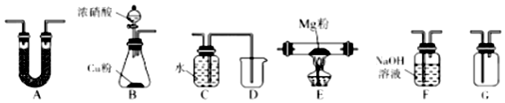
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com