
【题目】①溴水 ②氯水 ③碘酒 ④氯化钾 ⑤酸性高锰酸钾溶液。能使湿润的淀粉KI试纸变蓝的是( )
A. ①②③ B. ①⑤ C. ①②③⑤ D. ③④⑤
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
【题目】配制500 mL0.5 mol·L-1的NaOH溶液,试回答下列问题:
(1)计算:需要NaOH固体的质量为____________。(精确到0.1g)
(2)有以下仪器:①烧杯 ②100ml量筒 ③1000ml容量瓶 ④500mL容量瓶 ⑤玻璃棒 ⑥托盘天平(带砝码) ⑦滴定管
(Ⅰ)配制时,必须使用的仪器有_____(填代号),还缺少的仪器是__;
(Ⅱ)实验两次用到玻璃棒,其作用分别是:______________、_____________。
(Ⅲ)配制时,一般可分为以下几个步骤:①称量②计算③溶解④摇匀⑤转移⑥洗涤⑦定容⑧冷却。其正确的操作顺序为_______________
(3)某学生实际配制NaOH溶液的浓度为0.48 mol·L-1,原因可能是_______。
A.使用滤纸称量氢氧化钠固体
B.容量瓶中原来存有少量蒸馏水
C.溶解后的烧杯未经多次洗涤
D.胶头滴管加水定容时俯视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①Fe2O3(s)+3C(s) ===2Fe(s)+3CO(g) ΔH=+494kJ·mol-1
②CO(g)+1/2O2(g) ===CO2(g) ΔH=-283 kJ·mol-1
③C(s)+1/2O2(g)===CO(g) ΔH=-110kJ·mol-1
则反应Fe2O3(s)+3C(s)+ 3/2O2(g) ===2Fe(s)+3CO2(g)的焓变是
A. -355 kJ B. +355 kJ C. -355 kJ mol-1 D. +355 kJ mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应既属于氧化还原反应,又是吸热反应的是( )
A.天然气在空气中燃烧的反应 B.灼热的木炭与CO2的反应
C.铁粉与稀硫酸的反应 D.Ba(OH)2 8H2O晶体与NH4Cl晶体的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组需要0.1 mol·L1 NaOH溶液480 mL。根据溶液的配制情况回答下列问题。
(1)根据计算,配制上述溶液用托盘天平称取的NaOH固体质量为_____克,在下图所示仪器中,配制上述溶液肯定不需要的是______(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器是___________________。

(2)配制时,其正确的操作顺序是___________(用字母表示,每个操作只用一次)。
A.用少量水洗涤烧杯2次~3次,洗涤液均注入容量瓶,振荡
B.在盛有NaOH固体的烧杯中加入适量水溶解
C.将烧杯中已冷却的溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,反复上下颠倒,摇匀
E.改用胶头滴管加水,使溶液凹液面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1 cm~2 cm处
(3)关于容量瓶的四种叙述:①是配制准确浓度溶液的仪器;②不宜贮存溶液;③不能用来加热;④使用之前要检查是否漏水。这些叙述中正确的是_________(填字母)。
A.②③④ B.②③ C.①②④ D.①②③④
(4)从该溶液中取出10 mL,其中NaOH的物质的量浓度为________,含NaOH的质量为________。
(5)下面操作造成所配NaOH溶液浓度偏高的是____________(填字母)。
A.溶解后溶液没有冷却到室温就转移
B.转移时没有洗涤烧杯、玻璃棒
C.向容量瓶加水定容时眼睛俯视液面
D.摇匀后发现液面低于刻度线,又加蒸馏水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 离子化合物中不可能含有共价键 B. 含有离子键的化合物必是离子化合物
C. 共价化合物可能含离子键 D. 含有共价键的化合物必是共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下向10 mL 0.1 mol·L-1NaOH溶液中加入0.1 mol·L-1的一元酸HA,溶液pH的变化曲线如图所示。下列说法正确的是( )

A. a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA)
B. a、b两点所示溶液中水的电离程度相同
C. pH=7时,c(Na+)=c(A-)+c(HA)
D. b点所示溶液中c(A-)>c(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工业残渣主要成分为Fe2O3(含有少量FeO、Cu、Mg等杂质)。某课外兴趣小组利用该残渣制取Fe2O3粉末的流程如下:(说明:流程中“向黄色溶液加入MgO”的目的是调节溶液的酸碱性,使Fe3+生成沉淀而Mg2+不沉淀。)
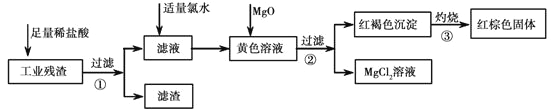
请回答下列问题:
(1)加入足量稀盐酸后,发生化学反应的类型有_____________(填写代号)。
A. 氧化还原反应 B.化合反应 C.分解反应 D.复分解反应
(2)加入适量氯水的作用是____________________________.
(3)写出灼烧红褐色沉淀时发生反应的化学方程式_____________________。实验室灼烧红褐色沉淀可选用的装置是__________(填序号)。

(4)若向黄色溶液中加入过滤①后的滤渣,发生反应的离子方程式为___________。
(5)检验黄色溶液中Fe3+是否完全沉淀的方法是:取过滤②后的少量滤液于试管中,____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com