
 下图中的实验装置可以用于实验室制取乙炔.请填空:
下图中的实验装置可以用于实验室制取乙炔.请填空:

科目:高中化学 来源: 题型:
| A、元素性质呈周期性变化的根本原因是元素化合价呈周期性变化 |
| B、BF3和CO2分子中所有原子均满足最外层为8电子结构 |
| C、已知114号元素的一种核素的质量数为298,则该元素的相对原子质量为298 |
| D、[14NH3T]+ 中,电子数、质子数、中子数之比为10:11:9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 容器 | 起始时各物质的量(mol) | 到达平衡时放出 的热量(QkJ) |
平衡时SO2转化率(X) | |||
| SO2 | O2 | SO3 | N2 | |||
| 甲 | 2 | 1 | 0 | 0 | Q1 | X1 |
| 乙 | 1 | 0.5 | 0 | 0 | Q2=39.4 | X2 |
| 丙 | 1 | 0.5 | 0 | 1 | Q3 | X3 |
| 丁 | 1.8 | 0.9 | 0.2 | 0 | Q4 | X4 |
| A、Q1=78.8 |
| B、Q1=Q4>Q2=Q3 |
| C、X1>X3=40% |
| D、X1=X4>X2=X3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.查看答案和解析>>
科目:高中化学 来源: 题型:
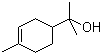 )的分子式为
)的分子式为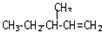 一定条件发生加聚反应时的化学方程式
一定条件发生加聚反应时的化学方程式查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:
合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:| 温 度(℃) | 360 | 440 | 520 |
| K值 | 0.036 | 0.010 | 0.0038 |
| n(H2O) |
| n(CH4) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com