
25oC时,取浓度均为0.1 mol·L-1的醋酸溶液和氨水溶液各20 mL,分别用0.1 mol·L-1NaOH溶液、0.1 mol·L-1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示。下列说法正确的是
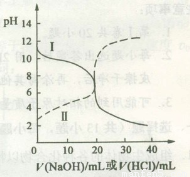
A.曲线I中滴加溶液到10 mL时:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
B.曲线I中滴加溶液到25 mL时:c(NH4+)>c(C1-)>c(H+)>c(OH-)
C.曲线II中滴加溶液在10 mL~25 mL之间存在:c(NH4+)=c(Cl-)>c(OH-)=c(H+)
D.曲线II中滴加溶液到10mL时:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)]
D
【解析】
试题分析:A、曲线I滴定前溶液的pH大于7,为盐酸滴定氨水,当滴加溶液到10 mL时,溶液中含有等浓度的NH3?H2O和NH4Cl,不含CH3COO?,错误;曲线I中滴加溶液到25 mL时,溶液含NH4Cl和少量的HCl,离子浓度大小顺序为:c(C1-) > c(NH4+)>c(H+)>c(OH-),错误;C、曲线II滴定前溶液的pH小于7,为NaOH溶液滴定醋酸,溶液不存在NH4+和Cl?,错误;D、曲线II中滴加溶液到10mL时,溶液含有等浓度的CH3COOH和CH3COONa,根据电荷守恒可得:c(CH3COO?)+c(OH?)=c(Na+)+c(H+),根据物料守恒可得:c(CH3COOH)+c(CH3COO?)=2c(Na+),①式×2—②式可得:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)],正确。
考点:本题考查酸碱中和滴定、离子浓度比较。


湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com