
【题目】已知在一定温度下,一定体积的密闭容器里存在如下平衡:2SO2(g)+O2(g)![]() 2SO3(g),若开始时充入2 mol SO3,达到平衡时混合气体的压强比起始时增大了10%;若开始时充入2 mol SO2和1 mol O2,则达到平衡时SO2的转化率为
2SO3(g),若开始时充入2 mol SO3,达到平衡时混合气体的压强比起始时增大了10%;若开始时充入2 mol SO2和1 mol O2,则达到平衡时SO2的转化率为
A. 20% B. 60% C. 80% D. 90%
【答案】C
【解析】
初始投入2molSO3与初始投入2molSO2和1molO2相当,在相同温度、相同体积的容器里,分别达到的平衡互为等效平衡,由此分析。
若开始时充入2molSO3,设达到平衡时O2的物质的量为x,则有下列关系:
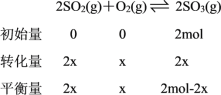
相同温度和相同体积条件下,气体的压强与气体物质的量成正比,则有![]() ,
,![]() ,解得x=0.2mol。则平衡时O2有0.2mol、SO2有0.4mol、SO3有1.6mol。
,解得x=0.2mol。则平衡时O2有0.2mol、SO2有0.4mol、SO3有1.6mol。
若开始时充入2molSO2和1molO2,达到的平衡与上述平衡等效,则平衡时相应组分的物质的量相同,即平衡时SO2的物质的量为0.4mol,此时反应中转化的SO2物质的量为2mol-0.4mol=1.6mol,则达到平衡时SO2的转化率=![]() ,答案选C。
,答案选C。


科目:高中化学 来源: 题型:
【题目】标准状况下,1体积水中能溶解500体积的HCl气体。若向水中通入标准状况下的44.8 L HCl气体配成1 L溶液,假设气体完全溶解,所得溶液中含HCl的物质的量浓度为________;若所得溶液密度为1.1 g·cm-3,则溶液中含HCl的质量分数为________;从该溶液中取出10 mL浓盐酸溶解于水中配制成250 mL溶液,配制后的稀溶液中含HCl物质的量浓度为________。在用浓盐酸配制上述稀盐酸时,所用仪器中,使用前必须检查是否漏液的仪器有________;配制过程中,造成浓度偏低的操作可能有________(选填下列操作的序号)。
A.容量瓶用蒸馏水洗后未加干燥
B.量筒用蒸馏水洗后未干燥
C.将烧杯中浓盐酸移入容量瓶后,未用水洗涤烧杯和玻璃棒,即向容量瓶中加水到刻度
D.用胶头滴管向容量瓶中加水时,不慎超过刻度线,用另外胶头滴管从瓶中吸出部分溶液使剩余溶液刚好达刻度线
E.定容时,俯视液面加水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车安全气囊中填充叠氮酸钠![]() 和硝酸钾
和硝酸钾![]() 。汽车发生猛烈撞击时,
。汽车发生猛烈撞击时,![]() 会迅速分解产生
会迅速分解产生![]() 和Na,Na单质可与
和Na,Na单质可与![]() 继续反应。完成下列填空:
继续反应。完成下列填空:
![]() 原子最外层电子的电子排布式为______,氮气的电子式为______。
原子最外层电子的电子排布式为______,氮气的电子式为______。
![]() 请将
请将![]() 、
、![]() 、
、![]() 按照离子半径由大到小的顺序排列______
按照离子半径由大到小的顺序排列______![]() 填离子符号
填离子符号![]() 。
。
![]() 的金属性强于Na,用一个事实说明______。
的金属性强于Na,用一个事实说明______。
![]() 配平Na与
配平Na与![]() 反应的化学方程式,并标出电子转移的方向与数目:
反应的化学方程式,并标出电子转移的方向与数目:
______![]() ______
______![]() ______
______![]() ______
______![]() ,若标准状况下生成
,若标准状况下生成![]() 氮气,转移的电子数目为______
氮气,转移的电子数目为______![]() 。
。
![]() 请解释
请解释![]() 晶体比
晶体比![]() 晶体熔点低的原因______。
晶体熔点低的原因______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知8gA能与32gB恰好完全反应,生成22gC和一定量的D;现将16gA与70gB混合,充分反应后,生成2molD和一定量的C,则D的摩尔质量为___g/mol。
(2)在VLAl2(SO4)3溶液中,测得铝元素的质量为ag。则溶液中含有硫元素的质量是___g,SO42-的物质的量浓度为__mol/L。
(3)在相同状况下某钢质空瓶,若装满O2,称其质量为36g,若装满CO2,称其质量为42g,若装满A气体,称其质量为52g,则A的相对分子质量是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物是造成大气污染的主要物质。研究氮氧化物的反应机理,对于消除环境污染有重要意义。请回答下列问题:
(1)已知:H2的燃烧热△H为-285.8kJ/mol。
N2(g)+2O2(g)=2NO2(g) △H=+133 kJ/mol
H2O(g)=H2O(1) △H=-44 kJ/mol
则H2和NO2反应生成两种无污染的气体的热化学反应方程式为______________________。
(2)一定温度下,向2L恒容密闭容器中充入0.40molN2O4,发生反应:N2O4(g)![]() 2NO2(g),一段时间后达到平衡,测得数据如下:
2NO2(g),一段时间后达到平衡,测得数据如下:
时间/s | 20 | 40 | 60 | 80 | 100 |
c(NO2)/(mol/L) | 0.12 | 0.20 | 0.26 | 0.30 | 0.30 |
①0~40s内,v(NO2)=___________。
②升高温度时,气体颜色加深,则上述反应是___________(填“放热”或“吸热”)反应。
③该温度下反应的化学平衡常数K=___________。
④相同温度下,若开始向该容器中充入0.80molN2O4,则达到平衡后c(NO2)___________(填“>”=”或”<”)0.60mol/L
(3)已知2NO(g)+O2(g)![]() 2NO2(g) △H的反应历程分两步:
2NO2(g) △H的反应历程分两步:
①2NO(g)![]() N2O2(g)(快) △H1<0,v1正=k1正c2(NO),v1逆=k1逆c(N2O2)
N2O2(g)(快) △H1<0,v1正=k1正c2(NO),v1逆=k1逆c(N2O2)
②N2O2(g)+O2(g)![]() 2NO2(g)(慢) △H2<O,v2正=k2正c (N2O2)·c(O2),v2逆=k2逆c 2(NO2)
2NO2(g)(慢) △H2<O,v2正=k2正c (N2O2)·c(O2),v2逆=k2逆c 2(NO2)
比较反应①的活化能E1与反应②的活化能E2的大小:E1___________E2(填“>”“<”或“=”),其判断理由是____________________;2NO(g)+O2(g)![]() 2NO2(g)的平衡常数K与上述反应速率常数k1正、k1逆、k2正/span>、k2逆的关系式为______________________。
2NO2(g)的平衡常数K与上述反应速率常数k1正、k1逆、k2正/span>、k2逆的关系式为______________________。
(4)N2O5是绿色硝化试剂,溶于水可得硝酸。下图是以N2O4为原料电解制备N2O的装置。写出阳极区生成N2O5的电极反应式(注意阳极区为无水环境,HNO3亦无法电离): _________________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实与浓硫酸表现出的性质(括号中)对应关系正确的是( )
A.在空气中敞口久置的浓硫酸,溶液质量增大(脱水性)
B.浓硫酸可用来干燥某些气体(脱水性)
C.蔗糖与浓硫酸反应中有海绵状的炭生成(吸水性)
D.在加热条件下铜与浓硫酸反应(氧化性、酸性)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学电池在通讯、交通及日常生活中有着广泛的应用。
(1)下列相关说法正确的是______________
A.通过某种电池单位质量或单位体积所能输出能量的多少,来判断该电池的优劣
B.二次电池又称充电电池或蓄电池,这类电池可无限次重复使用
C.除氢气外,甲醇、甲烷、乙烷等都可用作燃料电池的燃料
D.近年来,废电池必须进行集中处理的问题被提到议事日程,其首要原因是电池外壳的金属材料需要回收
(2)目前常用的镍(Ni)镉(Cd)电池,其电池总反应可表示为:
Cd+2NiO(OH)+2H2O ![]() 2Ni(OH) 2+Cd(OH)2
2Ni(OH) 2+Cd(OH)2
已知Ni(OH) 2和Cd(OH) 2均难溶于水,但能溶于酸,下列说法正确的是:_____
A.以上反应是可逆反应 B.反应环境为碱性
C.电池放电时Cd作负极 D.该电池是一种二次电池
(3)航天技术中使用的氢氧燃料电池具有高能、轻便和无污染的优点。氢氧燃料电池有酸式和碱式两种,它们放电时的电池总反应式均为:2H2+O2===2H2O。
①碱式电池中的电解质是KOH,其负极反应式为2H2-4e-+4OH-===4H2O,则其正极反应可表示为________________,电池工作一段时间后,电解质溶液的pH__________(填“增大”“减小”或“不变”)。
②若该电池为飞行员提供了36 kg的水,则电路中通过了_______mol电子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学为探究H2O2、H2SO3、Br2氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。

实验记录如下:

请回答下列问题:
(1)A中反应的离子方程式是__________________________________________________。
(2)实验操作Ⅱ吹入热空气的目的是_________________________________________。
(3)装置C的作用是____________,C中盛放的药品是_____________。
(4)实验操作Ⅲ,混合液逐渐变成红棕色,其对应的离子方程式_______________________。
(5)由上述实验得出的结论是_________________________________________________。
(6)实验反思:
①有同学认为实验操作Ⅱ吹入的热空气,会干扰(5)中结论的得出,你认为是否干扰,理由是_____________________________________________________________________。
②实验操作Ⅲ,开始时颜色无明显变化的原因是(写出一条即可):____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com