
【题目】NA表示阿伏加德罗常数的值,下列说法正确的是( ) 
A.5.6 g铁粉在0.1mol氯气中充分燃烧,转移电子数为0.3NA
B.12.5mL 16molL﹣1浓硫酸与足量铜反应,转移电子数为0.2NA
C.7.8g Na2S和Na2O2的混合物中含有的阴离子数等于0.1NA
D.0.5mol雄黄(As4S4 , 结构如图)含有NA个S﹣S键
【答案】C
【解析】解:A、5.6g铁粉的物质的量为0.1mol,铁在氯气中燃烧生成氯化铁,反应方程式为2Fe+3Cl2=2FeCl3 , 所以氯气的物质的量不足,根据氯气计算转移电子数,氯元素化合价由0价降低为﹣1价,所以转移电子数为0.1mol×2×NAmol﹣1=0.2NA ,
故A错误;
B、发生反应Cu+2H2SO4(浓)=CuSO4+SO2↑+2H2O12.5mL 16molL﹣1 , 由方程式可知其氧化剂的硫酸占 ![]() ,12.5mL16molL﹣1浓硫酸中硫酸完全反应,转移电子数为0.0125L×16molL﹣1×
,12.5mL16molL﹣1浓硫酸中硫酸完全反应,转移电子数为0.0125L×16molL﹣1× ![]() ×2×NAmol﹣1=0.2NA , 随反应进行浓硫酸变为稀硫酸,稀硫酸不与铜反应,所以转移电子数小于0.2NA , 故B错误;
×2×NAmol﹣1=0.2NA , 随反应进行浓硫酸变为稀硫酸,稀硫酸不与铜反应,所以转移电子数小于0.2NA , 故B错误;
C、Na2S和Na2O2的摩尔质量都是78g/mol,7.8g 混合物的物质的量为0.1mol,硫化钠是由钠离子与硫离子构成,过氧化钠由钠离子与过氧根离子构成,每摩尔Na2S和Na2O2都含1mol阴离子,所以7.8g Na2S和Na2O2的混合物中含有的阴离子为0.1mol,阴离子数等于0.1NA , 故C正确;
D、黑色球为As,白色球为S,分子中不存在S﹣S键,故D错误.
故选:C.


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:
【题目】)秋葵是一种大众喜爱的食材,含有蛋白质、维生素A、维生素C、纤维素、阿拉伯果糖和丰富的铁、锌、钙等元素,其中: ①属于人体所需微量元素的是 .
②属于水溶性维生素的是 , 属于糖类的有阿拉伯果糖、 .
③蛋白质在人体内最终的水解产物是 . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化合物中,在核磁共振氢谱图中能够给出三种信号的是( )
A.CH3CH2CH3
B.CH3COCH2CH3
C.CH3OCH3
D.CH3COOCH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向300mL KOH溶液中缓慢通入一定量的CO2气体,充分反应后,在减压低温下蒸发溶液,得到白色固体.请回答下列问题:
(1)由于CO2通入量不同,所得到的白色固体的组成也不同,试推断有几种可能的组成,并分别列出.
(2)若通入CO2气体为2.24L(标准状况下),得到11.9g的白色团体.请通过计算确定此白色固体是由哪些物质组成的?其质量各为多少?所用的KOH溶液的物质的量浓度为多少.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】学习小组拟通过实验,探究Mg(NO3)2受热分解的产物.
小组猜想:ⅰ.固体产物可能有Mg(NO2)2、MgO、Mg3N2中的一种或几种
ⅱ.气体产物可能有NO2、N2、O2中的一种或几种
查得相关资料:a.Mg(NO2)2、Mg(NO3)2易溶于水,MgO难溶于水.
b.2NO2+2NaOH=NaNO3+NaNO2+H2O
c.Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑
针对以上猜想,设计了如图所示实验(图中加热、夹持仪器等装置均省略):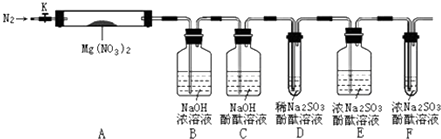
进行实验
Ⅰ.检验上述装置气密性.
Ⅱ.称取3.7gMg(NO3)2固体,置入硬质玻璃管A中,打开K,通入一段时间N2 , 并进行相关物质质量称量
Ⅲ.关闭K,用酒精灯持续给装置A加热,过程中各装置内溶液均未倒吸入其它装置.
Ⅳ.待Mg(NO3)2完全分解,装置冷却至室温,打开K,再缓慢通入一会N2后并再称量.称得A中剩余固体质量为1.0g,B、C、D、E、F中溶液质量分别增加了2.3g、0.0g、0.1g、0.3g、0.05g.
Ⅴ.取少量剩余固体于试管中,加入适量水,未出现明显现象.
(1)回答问题
①小组预测一定有O2生成,理由是 .
②N2的电子式是 , 步骤Ⅱ中,通入一段时间N2的目的是 .
③步骤Ⅲ中,装置A内若出现了红棕色气体,其化学式是 .
④装置C中若红色始终未褪,其设计的目的是 .
⑤实验中发现Mg(NO3)2分解时有O2生成,其实验现象是 , 用化学用语解释,产生上述现象的原因是 .
⑥实验中Mg(NO3)2分解没有N2生成的理由是 .
⑦Mg(NO3)2分解的化学方程式是 .
⑧装置F中溶液质量增加的原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝镁合金已成为飞机制造、化工生产等行业的重要材料。研究性学习小组的同学,为测定某含镁3%~5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列两种不同实验方案进行探究。填写下列空白。
[方案一]
〖实验方案〗将铝镁合金与足量NaOH溶液反应,测定剩余固体质量。
(1)实验中发生反应的化学方程式是___________________________。
(2)称取5.4g铝镁合金粉末样品,溶于V mL 2.0 mol/L NaOH溶液中。为使其反应完全,则NaOH溶液的体积V ≥ ______________。过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将_________(填“偏高”、“偏低”或“无影响”)。
[方案二]
〖实验方案〗将铝镁合金与足量稀硫酸溶液反应,测定生成气体在通常状况(约20℃,1.01![]() 105Pa)的体积。
105Pa)的体积。
〖问题讨论〗(3)同学们拟选用图一实验装置完成实验:

①你认为最简易的装置其连接顺序是:A接(____)(_____)接(____)( )接( )(填接口字母,可不填满。)②实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开分液漏斗可旋转的活塞,一会儿后稀硫酸也不能顺利滴入锥形瓶中。请你帮助分析原因_________________________。
③实验结束时,在读取测量实验中生成氢气的体积时,你认为最合理的是__________。(有几个选几个)。
A.等待实验装置冷却后再读数
B.上下移动量筒F,使其中液面与广口瓶中液面相平
C.上下移动量筒G,使其中液面与广口瓶中液面相平
D.视线与凹液面的最低点水平,读取量筒中水的体积
(4)仔细分析实验装置后,同学们经讨论认为以下两点会引起较大误差:稀硫酸滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小。于是他们设计了图二的实验装置。

①装置中导管a的作用是_________________________。
②实验前后碱式滴定管中液面读数分别为V1 mL、V2 mL。则产生氢气的体积为_________mL。(用含V1、V2的式子表达)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L密闭容器中,发生3A(g)+B(g)2C(g)反应,若最初加入A和B都是4mol,A的平均反应速率为0.12mol/(Ls),则10秒钟后容器中的B是( )
A.2.8mol
B.1.6mol
C.3.2mol
D.3.6mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com