
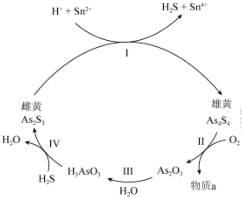
分析 (1)①Ⅰ中Sn的化合价升高,As的化合价降低;
②Ⅱ中,若1molAs4S4反应转移28mole-,则反应消耗7mol氧气,根据原子守恒书写;
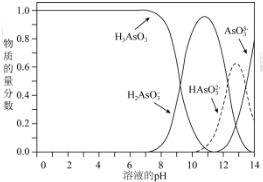
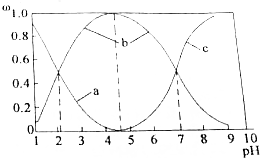
(2)①根据图象结合pH分析;
②将KOH 溶液滴入亚砷酸溶液,当pH 调至11时,亚砷酸与氢氧根离子反应生成H2AsO3-;
③a.n(H3AsO3):n(H2AsO3-)=1:1时,溶液的pH=9;
b.pH=12时,溶液显碱性;
c.在K3AsO3溶液中,存在三步水解,以第一步水解为主;
(3)铁盐混凝剂在溶液中生产Fe(OH)3胶粒,其表面带有正电荷,可吸附含砷化合物;由图(2)可知,pH=5~9之间溶液中主要存在微粒为H3AsO3和H2AsO3-,而且H2AsO3-随着溶液中pH的增大而增大,H2AsO3-含量多,则静电作用的吸附性更强.
解答 解:(1)①Ⅰ中Sn的化合价升高,As的化合价降低,所以As2S3在反应中得电子作氧化剂;
故答案为:As2S3;
②Ⅱ中,若1molAs4S4反应转移28mole-,则反应消耗7mol氧气,则反应的方程式为:As4S4+7O2$\frac{\underline{\;一定条件下\;}}{\;}$2As2O3+4SO2;
故答案为:As4S4+7O2=$\frac{\underline{\;一定条件下\;}}{\;}$2As2O3+4SO2;
(2)①由图象可知,pH在7.35-7.45之间,溶液中含砷元素的主要微粒是H3AsO3;
故答案为:H3AsO3;
②将KOH 溶液滴入亚砷酸溶液,当pH 调至11时,亚砷酸与氢氧根离子反应生成H2AsO3-,其反应的离子方程为:H3AsO3+OH-=H2AsO3-+H2O;
故答案为:H3AsO3+OH-=H2AsO3-+H2O;
③a.n(H3AsO3):n(H2AsO3-)=1:1时,溶液的pH=9,所以溶液显碱性,故正确;
b.pH=12时,溶液显碱性,则c(OH-)>c(H+),所以c(H2AsO3-)+2c(HAsO32-)+3c(AsO33-)+c(OH-)>c(H+),故错误;
c.在K3AsO3溶液中,存在三步水解,以第一步水解为主,第一步水解生成HAsO32-,第二步水解生成H2AsO3-,则c(AsO33-)>c(HAsO32-)>c(H2AsO3-),故正确;
故答案为:ac;
(3)铁盐混凝剂在溶液中生产Fe(OH)3胶粒,其表面带有正电荷,可吸附含砷化合物;由图(2)可知,pH=5~9之间溶液中主要存在微粒为H3AsO3和H2AsO3-,而且H2AsO3-随着溶液中pH的增大而增大,H2AsO3-含量多,则静电作用的吸附性更强,此外,pH升高有利于水解,促进Fe(OH)3的生成,Fe(OH)3的含量高,吸收效果更好;
故答案为:pH=5~9之间溶液中主要存在微粒为H3AsO3和H2AsO3-,由于Fe(OH)3胶粒表面带正电荷,可以吸附负电荷,随着溶液中pH的增大而增大,H2AsO3-含量多,吸附效果好,此外,pH升高有利于水解,促进Fe(OH)3的生成,Fe(OH)3的含量高,吸收效果更好.
点评 本题考查了元素化合物的性质的综合应用、溶液中离子浓度大小比较、离子方程式的书写、胶体的性质等,题目难度中等,侧重于基础知识的综合应用能力的考查,注意把握题目中的信息以及对图象的分析理解.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
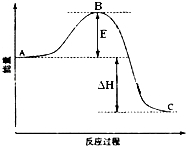 2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1.请回答下列问题:
2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 豆科植物的根瘤菌固氮 | B. | .由氮气和氢气合成氨气 | ||
| C. | .雷雨天,空气中的氮气和氧气反应 | D. | .氨催化氧化制硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硒化氢(H2Se)是有色、有毒的气体,比H2S稳定 | |
| B. | 砹(At)为有色固体,AgAt难溶于水也不溶于稀硝酸 | |
| C. | 在氧气中,铷(Rb)的燃烧产物比钠的燃烧产物更复杂 | |
| D. | 硫酸锶(SrSO4)是难溶于水的白色固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:B>A>C>D | B. | 原子序数:d>c>b>a | ||
| C. | 离子半径:D ->C 2->B +>A 2+ | D. | 离子的还原性:D ->C 2- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
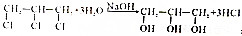 一个碳上连有两个烃基不隐定,容易失去一份水,试回答下列问题:
一个碳上连有两个烃基不隐定,容易失去一份水,试回答下列问题:

 +2NaOH$→_{△}^{水}$
+2NaOH$→_{△}^{水}$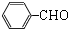 +2NaCl+2H2O
+2NaCl+2H2O .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 氯化亚砜(SOCl2)液体是一种重要的有机合成试剂,还用于农药、医药、燃料的生产等.回答下列问题:
氯化亚砜(SOCl2)液体是一种重要的有机合成试剂,还用于农药、医药、燃料的生产等.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com