
【题目】某有机物甲经水解可得乙,乙在一定条件下经氧化后可得丙,lmol丙和2mol甲反应得一种含氯的酯(C6H8O4Cl2)。由此推断有机物甲的结构简式为( )
A. Cl-CH2CHO B. HOCH2CH2Cl C. Cl-CH2COOH D. HOOC-COOH
科目:高中化学 来源: 题型:
【题目】利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。T℃时反应
2SO2(g)+O2(g)![]() 2SO3(g)过程中的能量变化如图所示,回答下列问题。
2SO3(g)过程中的能量变化如图所示,回答下列问题。

(1)T℃时将3molSO2和1molO2通入体积为2L的恒温恒容密闭容器中,发生反应。2min时反应达到平衡,此时测得反应物O2还剩余0.1mol,则达到平衡时SO2的转化率为_______,反应放出_____________热量。(用E1、E2或E3表示)
(2)下列叙述能证明该反应已达化学平衡状态的是__________________(填序号)
①SO2的体积分数不再发生变化 ②容器内压强不再发生变化 ③容器内气体原子总数不再发生变化 ④相同时间内消耗2n molSO2的同时生成n molO2 ⑤相同时间内消耗2n molSO2的同时生成2n molSO3
(3)在反应体系中加入催化剂,反应速率增大, E3的变化是: E3 ____________(填“增大”“减小”或“不变”)
(4)若以下图所示装置,用电化学原理生产硫酸,将SO2、O2以一定压强喷到活性电极上反应。写出通SO2电极的电极反应式:______________________________________________。

(5) SOCl2是一种无色液体,可与碳共同构成锂电池的正极材料,且其放电时也有SO2气体产生。写出SOCl2在电池中放电时的电极反应式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生产上用过量烧碱溶液处理某矿物(含Al2O3、MgO),过滤后得到滤液用NaHCO3溶液处理,测得溶液pH和Al(OH)3生成的量随加入NaHCO3溶液体积变化的曲线如下:

下列有关说法不正确的是
A. NaHCO3溶液的物质的量浓度为0.8 mol/L
B. b点与c点溶液所含微粒种类相同
C. a点溶液中存在的离子是Na+、AlO2-、OH-、H+
D. 生成沉淀的离子方程式为:HCO3-+AlO2-+H2O === Al(OH)3↓+CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应aA (g) +bB (s) ![]() cC (g) +dD (g),其他条件不变,C的物质的量分数中(C)和温度(T)或压强(P)关系如图,其中正确的是
cC (g) +dD (g),其他条件不变,C的物质的量分数中(C)和温度(T)或压强(P)关系如图,其中正确的是
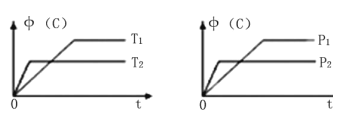
A. 降低温度,平衡正向移动 B. 使用催化剂,中(C)增加
C. 化学方程式系数a+b<c+d D. 其它条件不变,加入B,平衡正向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上由黄铜矿(主要成分CuFeS2,质量分数为90%)冶炼铜的主要流程如下:

己知:一定条件下,铝可以和某些金属氧化物反应置换金属
(1)高温焙烧前要将黄铜矿粉碎的目的是_________________。
(2)气体A中的大气污染物可选用下列试剂中的____________吸收。
a.浓H2SO4 b.稀HNO3 c.NaOH溶液 d.氨水
(3)用稀H2SO4浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,说明溶液中存在____(填离子符号),欲检验溶液中还存在Fe2+,所需试剂是_________。
(4)由泡铜冶炼粗铜的化学反应方程式为_________。
(5)某同学用铜、稀硫酸和H2O2制备CuSO4溶液,其化学反应方程式为_________,反应停止后除去溶液中过量的H2O2的简便方法是_____________。
(6)1.15吨该黄铜矿理论上可以得到含杂质10%的粗铜质量为_________kg(冶炼过程中铜损失忽略不计)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含有KI、NaBr的混合溶液中通入过量的Cl2充分反应。将溶液蒸干并灼烧,最后剩余的固体物质是( )
A.KI和NaBr B.KCl和NaCl C.KCl和NaBr D.KCl、NaCl和I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是( )
A.锌粒与稀盐酸反应:Zn+2H+=Zn2++H2↑
B.溴化钠溶液与氯气反应:Br﹣+Cl2=Cl﹣+Br2
C.氢氧化铜与稀硫酸反应:OH﹣+H+=H2O
D.钠与水反应:Na++2H2O=Na++2OH﹣+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖的漂白和杀菌,其一种生产工艺流程如下:

回答下列问题:
(1) 写出“反应”步骤中生成ClO2的化学方程式:________________________。
(2) “电解”所用食盐水由粗盐水精制而成,精制时为除去Mg2+和Ca2+,要加入的试剂分别为___________________、___________________。

(3) 亚氯酸钠(NaClO2)在水溶液中可生成ClO2、HClO2、ClO![]() 、Cl-等,其中HClO2和ClO2都具有漂白作用。经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出)。则使用该漂白剂的适宜pH________(填“大于”“ 等于”或“小于”)3。
、Cl-等,其中HClO2和ClO2都具有漂白作用。经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出)。则使用该漂白剂的适宜pH________(填“大于”“ 等于”或“小于”)3。
(4) 为了测定NaClO2·3H2O的纯度,取上述合成产品10.00 g溶于水配成1000 mL溶液,取出20.00 mL溶液于锥形瓶中,再加入足量硫酸酸化的KI溶液,充分反应后加入2~3滴淀粉溶液,用0.2640 mol·L-1Na2S2O3标准溶液滴定,共用去Na2S2O3标准溶液20.00 mL,通过计算确定该产品纯度是否合格?(合格纯度在90%以上)(写出计算过程)__________
提示: 2Na2S2O3+I2===Na2S4O6+2NaI。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正丁醚常用作有机反应的溶剂。实验室制备正丁醚的反应和主要实验装置如下:
2CH3CH2CH2CH2OH![]() (CH3CH2CH2CH2)2O + H2O。反应物和产物的相关数据如下
(CH3CH2CH2CH2)2O + H2O。反应物和产物的相关数据如下

相对分子质量 | 沸点/℃ | 密度/(g·cm-3) | 水中溶解性 | |
正丁醇 | 74 | 117.2 | 0.8109 | 微溶 |
正丁醚 | 130 | 142.0 | 0.7704 | 几乎不溶 |
合成反应:
①将6 mL浓硫酸和37 g正丁醇,按一定顺序添加到A中,并加几粒沸石。
②加热A中反应液,迅速升温至135℃,维持反应一段时间。
分离提纯:
③待A中液体冷却后将其缓慢倒入盛有70 mL水的分液漏斗中,振荡后静置,分液得粗产物。
④粗产物依次用40 mL水、20 mL NaOH溶液和40 mL水洗涤,分液后加入约3 g无水氯化钙颗粒,静置一段时间后弃去氯化钙。
⑤将上述处理过的粗产物进行蒸馏,收集馏分,得纯净正丁醚11 g。
请回答:
(1)步骤①中浓硫酸和正丁醇的添加顺序为 。
(2)加热A前,需先从 (填“a”或“b”)口向B中通入水。
(3)步骤③的目的是初步洗去 ,振荡后静置,粗产物应从分液漏斗的 (填“上”或“下”)口分离出。
(4)步骤④中最后一次水洗的目的为 。
(5)步骤⑤中,加热蒸馏时应收集 (填选项字母)左右的馏分。
a.100℃ b. 117℃ c. 135℃ d.142℃
(6)反应过程中会观察到分水器中收集到液体物质,且分为上下两层,随着反应的进行,分水器中液体逐渐增多至充满时,上层液体会从左侧支管自动流回A。分水器中上层液体的主要成分为 ,下层液体的主要成分为 。
(7)本实验中,正丁醚的产率为 。(保留两位有效数字)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com