
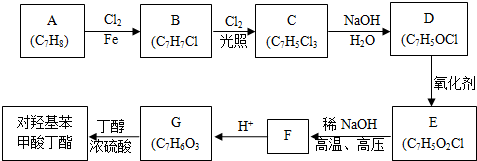
 ���ǻ��ױ����ᶡ�����׳��Ჴ����������������������ҵ�ϳ��ö��ǻ��������붡����Ũ������½���������Ӧ���Ƶã���
���ǻ��ױ����ᶡ�����׳��Ჴ����������������������ҵ�ϳ��ö��ǻ��������붡����Ũ������½���������Ӧ���Ƶã���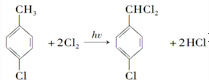 ��
�� ��
�� ��д�ṹ��ʽ����
��д�ṹ��ʽ���� ���� ��A�ķ���ʽΪC7H8�����պϳɶ��ǻ������ᶡ����֪��AΪ�ױ�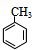 ���ױ����������������£���������λ�ϵ�Hԭ������������ȡ����Ӧ����B��BΪ
���ױ����������������£���������λ�ϵ�Hԭ������������ȡ����Ӧ����B��BΪ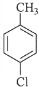 �������Ϣ�ڿ�֪��D�к���ȩ����B�ڹ��������£����ϵ�Hԭ������������ȡ����Ӧ����C��CΪ
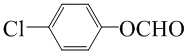
�������Ϣ�ڿ�֪��D�к���ȩ����B�ڹ��������£����ϵ�Hԭ������������ȡ����Ӧ����C��CΪ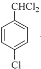 ��C����������ˮ��Һ�У����ϵ���ԭ�ӷ���ȡ����Ӧ������D�������Ϣ�ٿ�֪��DΪ
��C����������ˮ��Һ�У����ϵ���ԭ�ӷ���ȡ����Ӧ������D�������Ϣ�ٿ�֪��DΪ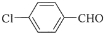 ��D�ڴ���������ȩ������������E��EΪ
��D�ڴ���������ȩ������������E��EΪ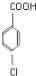 ���ڼ��Ը��¸�ѹ�����£������Ϣ�ۿ�֪�������ϵ�Clԭ�ӱ�ȡ������F��ͬʱ����������Ӧ��FΪ
���ڼ��Ը��¸�ѹ�����£������Ϣ�ۿ�֪�������ϵ�Clԭ�ӱ�ȡ������F��ͬʱ����������Ӧ��FΪ ��F�ữ���ɶ��ǻ�������G
��F�ữ���ɶ��ǻ�������G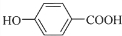 ����϶�Ӧ�л���Ľṹ�����ʽ����⣮
����϶�Ӧ�л���Ľṹ�����ʽ����⣮
��� �⣺��A�ķ���ʽΪC7H8�����պϳɶ��ǻ������ᶡ����֪��AΪ�ױ� ���ױ����������������£���������λ�ϵ�Hԭ������������ȡ����Ӧ����B��BΪ
���ױ����������������£���������λ�ϵ�Hԭ������������ȡ����Ӧ����B��BΪ �������Ϣ�ڿ�֪��D�к���ȩ����B�ڹ��������£����ϵ�Hԭ������������ȡ����Ӧ����C��CΪ
�������Ϣ�ڿ�֪��D�к���ȩ����B�ڹ��������£����ϵ�Hԭ������������ȡ����Ӧ����C��CΪ ��C����������ˮ��Һ�У����ϵ���ԭ�ӷ���ȡ����Ӧ������D�������Ϣ�ٿ�֪��DΪ
��C����������ˮ��Һ�У����ϵ���ԭ�ӷ���ȡ����Ӧ������D�������Ϣ�ٿ�֪��DΪ ��D�ڴ���������ȩ������������E��EΪ
��D�ڴ���������ȩ������������E��EΪ ���ڼ��Ը��¸�ѹ�����£������Ϣ�ۿ�֪�������ϵ�Clԭ�ӱ�ȡ������F��ͬʱ����������Ӧ��FΪ
���ڼ��Ը��¸�ѹ�����£������Ϣ�ۿ�֪�������ϵ�Clԭ�ӱ�ȡ������F��ͬʱ����������Ӧ��FΪ ��F�ữ���ɶ��ǻ�������G
��F�ữ���ɶ��ǻ�������G ��
��
��1�������Ϸ�����֪A�Ļ�ѧ����Ϊ�ױ����ʴ�Ϊ���ױ���
��2��FΪ ������ʽΪC7H4O3Na2���ʴ�Ϊ��C7H4O3Na2��
������ʽΪC7H4O3Na2���ʴ�Ϊ��C7H4O3Na2��
��3��BΪ ���������ڹ��������·���ȡ����Ӧ����
���������ڹ��������·���ȡ����Ӧ���� ������ʽΪ
������ʽΪ ��
��
�ʴ�Ϊ�� ��
��
��4�������Ϸ�����֪DΪ ��
��
�ʴ�Ϊ�� ��
��
��5��EΪ ��E��ͬ���칹����������ʽ��һ���DZ����Ϻ���һ��������һ����ԭ�ӣ��ڡ��䡢�ԣ���3���칹����һ������һ��ȩ����һ���ǻ���һ����ԭ�ӣ���3�ֲ�ͬ��ȡ��������10��ͬ���칹�壬���Թ�����13�֣����к˴Ź������������ֲ�ͬ��ѧ�������⣬�ҷ������Ϊ2��2��1����
��E��ͬ���칹����������ʽ��һ���DZ����Ϻ���һ��������һ����ԭ�ӣ��ڡ��䡢�ԣ���3���칹����һ������һ��ȩ����һ���ǻ���һ����ԭ�ӣ���3�ֲ�ͬ��ȡ��������10��ͬ���칹�壬���Թ�����13�֣����к˴Ź������������ֲ�ͬ��ѧ�������⣬�ҷ������Ϊ2��2��1���� ��
��
�ʴ�Ϊ��13�� ��
��
���� �������л���ѧ�е���Ҫ���ͣ������е��Ѷȵ����⣮���������߿����ۺ���ǿ����ע�ض�ѧ������֪ʶ������ѵ����ͬʱ�����ض�ѧ����������������ⷽ����ָ����ѵ�����л��ϳɹ�����Ҫ���������ŵ����롢�����ŵ������������ŵ��ܱ䡢̼�Ǽܵı仯�ȣ�ע����ݷ���ʽ��϶��ǻ������ᶡ��ȷ��A�Ľṹ�������ķ�Ӧ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Na2O2����ˮ����O2��Na2O2+H2O�T2Na++2OH-+O2�� | |
| B�� | Fe��OH��3��������Fe��OH��3+3H+�TFe3++3H2O | |
| C�� | ���������Һ��ͨ�����������̼��Ca2++2ClO-+H2O+CO2�TCaCO3��+2HClO | |
| D�� | ��һ������AlƬͶ��������NaOH��Һ�У�2Al+2OH-+2H2O�T2AlO2-+3H2�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ѿ�� | B�� | ���� | C�� | ��ά�� | D�� | ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢ۢܢ� | B�� | �٢ۢܢ� | C�� | �ڢۢޢ� | D�� | �ۢܢݢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �⻯������Һ��ͨ���������� 2Fe2++Cl2�T2Fe3++2Cl- | |
| B�� | ����SO2ͨ����������Һ�� Ca2++2ClO-+SO2+H2O�TCaSO3��+2HClO | |
| C�� | �ð�ˮ���չ����������� NH3•H2O+SO2�TNH4++HSO3- | |
| D�� | ����������Һ�м����������ữ�Ĺ���������Һ Fe2++2H++H2O2�TFe3++2H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | HCN�������������ǻ�ԭ�� | B�� | CaCN2�к��зǼ��Լ� | ||
| C�� | COΪ�������H2Ϊ��ԭ���� | D�� | ÿ����5g CaCO3����1.12L CO2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | $\frac{1}{2}$N2H4��g��+$\frac{1}{2}$O2��g���T$\frac{1}{2}$N2��g��+H2Og����H=-267.2 kJ•mol-l | |
| B�� | N2H4+O2�TN2+2H2O��H=-534.4 kJ•mol-l | |
| C�� | N2H4��g��+O2��g���TN2��g��+2H2O��1����H=-534.4 kJ•mol-l | |
| D�� | N2H4��g��+O2��g���TN2��g��+2H2O��g����H=534.4 kJ•mol-l |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �Ȼ�ѧ����ʽ�л�ѧ��������ʾ���Ӹ��� | |
| B�� | Q=483.6 | |
| C�� | Q��483.6 | |
| D�� | Q��483.6 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 0.05mol•L-1 | B�� | 0.1mol•L-1 | C�� | 0.15mol•L-1 | D�� | 0.2mol•L-1 |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com