
 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案科目:高中化学 来源: 题型:
A.硝酸铵自发地溶于水
B.2N2O5(g)![]() 4NO2(g)+O2(g) ΔH=+56.7 kJ· mol-1
4NO2(g)+O2(g) ΔH=+56.7 kJ· mol-1
C.(NH4)2CO3(s)![]() NH4HCO3(s)+NH3(g) ΔH=+74.9 kJ· mol-1
NH4HCO3(s)+NH3(g) ΔH=+74.9 kJ· mol-1
D.2H2(g)+O2(g)![]() 2H2O(l) ΔH=-285.8 kJ· mol-1
2H2O(l) ΔH=-285.8 kJ· mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应中,熵减小的是( )
A、(NH4)2CO3(s)=NH4HCO3(s)+NH3(g) B、2N2O5(g)=4NO2(g)+O2(g)
C、 MgCO3(s)=MgO(s)+CO2(g) D、2CO(g)=2C(s)+O2(g)
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江西省高三第四次模考化学试卷(解析版) 题型:选择题
一定温度下,在2L密闭容器中发生下列反应:4NO2(g)+O2(g)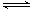 2N2O5(g);已知该反应的平衡常数:
2N2O5(g);已知该反应的平衡常数: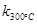 >
>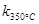 ,且体系中
,且体系中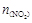 (单位:mol)随时间变化如下表:
(单位:mol)随时间变化如下表:
|
时间(s) |
0 |
500 |
1000 |
1500 |
|
t1℃ |
20 |
13.96 |
10.08 |
10.08 |
|
t2℃ |
20 |
a |
b |
c |
下列说法一定正确的是( )
A.正反应为吸热反应
B.如果t2℃<t1℃,那么 a>b=c,且a=10+0.5b
C.如果t2℃<t1℃,那么t2℃达到平衡的时间介于1000s至1500s之间
D.如果t2℃>t1℃,那么b>10.08
查看答案和解析>>
科目:高中化学 来源:2011-2012年浙江余姚中学高一下学期第一次质量检测化学实验班试卷(解析版) 题型:选择题
下列反应中,熵减小的是( )
A、(NH4)2CO3(s)=NH4HCO3(s)+NH3(g) B、2N2O5(g)=4NO2(g)+O2(g)
C、 MgCO3(s)=MgO(s)+CO2(g) D、2CO(g)=2C(s)+O2(g)
查看答案和解析>>
科目:高中化学 来源:2014届江西省高一下学期期中考试化学试卷(解析版) 题型:计算题
在2L的密闭容器中放入4molN2O5,发生如下反应:2N2O5(g)  4NO2(g)+
O2(g)。反应5min后,测得N2O5转化了20%,求:
4NO2(g)+
O2(g)。反应5min后,测得N2O5转化了20%,求:
(1)υ(NO2)、υ(O2)分别为多少?
(2)5min时,N2O5占混合气体总体积的百分比是多少?
(要求写出计算过程)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com