
下列反应所得溶液中一定只含一种溶质的是
A.向NaOH溶液中通入CO2
B.向Ca(OH)2溶液中通入Cl2
C.向蒸馏水中加入少量金属Na
D.向Al2(SO4)3溶液中滴入Ba(OH)2溶液
科目:高中化学 来源: 题型:
下列物质性质的变化规律,与共价键的键能大小有关的是
A.F2、Cl2、Br2、I2的熔点、沸点逐渐升高
B.HF、HCl、HBr、HI的热稳定性依次减弱
C.金刚石的硬度、熔点、沸点都高于晶体硅
D.NaF、NaCl、NaBr、NaI的熔点依次降低
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下,恒容密闭容器中,充入一定量的NO和O2,发生反应
O2(g)+2NO(g) 2 NO2(g) ,反应已达到平衡的标志是
2 NO2(g) ,反应已达到平衡的标志是
A.反应混合物中各组分的浓度相等
B.混合气体的密度不再改变
C.混合气体的颜色不再变化
D.O2 、NO、NO2三种物质的反应速率之比为1∶2 ∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
I.甲醇是一种重要的化工原料,有着重要的用途和应用前景。工业生产甲醇的常用方法是:CO(g)+2H2(g)===CH3OH(g) ΔH=-90.8 kJ·mol-1
已知:2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
H2(g)+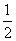 O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1
O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1
①H2的燃烧热ΔH= 。
②CH3OH(g)+O2(g)===CO(g)+2H2O(g) 的反应热ΔH= 。
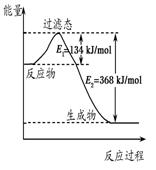
Ⅱ.(1)如右图是1 mol NO2(g)和1 mol CO(g)反应生成
CO2和NO过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是 ,ΔH的变化是________(填“增大”、“减小”或“不变”)。
写出该反应的热化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,其与水的离子反应是4FeO42-+10H2O===4Fe(OH)3(胶体)+3O2↑+8OH-,工业上先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入一定量的KOH就可制得高铁酸钾。制备高铁酸钠的两种方法的主要反应原理如下:
湿法制备:2Fe(OH)3+3ClO-+4OH-===2FeO42-+3Cl-+5H2O;
干法制备:2FeSO4+6Na2O2===2Na2FeO4+2Na2O+2Na2SO4+O2↑。
下列有关说法中错误的是
A.高铁酸钾与水反应时,水发生氧化反应
B.干法中每生成1 mol Na2FeO4共转移4 mol电子
C.湿法中每生成1 mol Na2FeO4共转移3 mol电子
D.K2FeO4处理水时,不仅能杀菌,并使悬浮杂质沉降
查看答案和解析>>
科目:高中化学 来源: 题型:
把足量的小苏打固体和少量的过氧化钠固体混合均匀后充分加热,最后留下的固体物质的化学式是
A.Na2CO3 B.NaOH和Na2CO3
C.Na2O2和Na2CO3 D.Na2O2、NaOH和Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
在含有Fe3+、Fe2+、Al3+、 的稀溶液中加入足量Na2O2固体,充分作用后,再加入过量稀盐酸,完全反应,则离子数目没有变化的是
A.Fe3+、Al3+ B.Al3+ C.Fe2+、 D.Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.K能层中不包含p能级 B.碳原子的电子排布式为1s22p4
C.3p3表示3p能级有三个轨道 D.同一原子中,2p、3p、4p能级的轨道数依次增加
查看答案和解析>>
科目:高中化学 来源: 题型:
请按要求写出下列化学方程式
①乙烯使硫酸酸化的高锰酸钾溶液褪色(乙烯被氧化为二氧化碳,高锰酸钾被还原为硫酸锰MnSO4)。
②甲苯在浓硫酸作催化剂的条件下与浓硝酸反应生成三硝基甲苯。
③乙醇使硫酸酸化的重铬酸钾溶液变色(乙醇被氧化为乙酸,重铬酸钾被还原为硫酸铬)。
④乙烯与氧气在银作催化剂的条件下反应生成环氧乙烷,且该反应的原子利用率为?
⑤对苯甲二甲酸与乙二醇缩聚反应生成聚酯纤维(涤纶)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com