
随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%。目前,消除大气污染有多种方法。
Ⅰ.处理NOx的一种方法是利用甲烷催化还原NOx。
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2
CH4(g)+2NO2 (g)=N2(g) + CO2(g)+2H2O(g) △H3=-867kJ·mol-1
则△H2= 。
Ⅱ.化石燃料的燃烧、含硫金属矿石的冶炼和硫酸的生产过程中产生的SO2是大气中SO2的主要来源。(1)将煤转化为水煤气是将煤转化为洁净燃料的方法之一,反应为 C(s) + H2O(g)= CO(g) + H2(g),
该反应的化学平衡常数表达式为K= 。 800℃时,将1molCO、3mol H2O、1mol H2充入容积为1L的容器中,发生反应:CO(g) + H2O(g)  CO2(g) + H2(g),反应过程中各物质的浓度如右图t1前所示变化。若保持温度不变,t2时再向容器中充入CO、H2各1mol,平衡将 移动(填“向左”、 “向右”或“不”)。t2时,若改变反应条件,导致H2浓度发生如右图t2后所示的变化,则改变的条件可能是 (填符号)。
CO2(g) + H2(g),反应过程中各物质的浓度如右图t1前所示变化。若保持温度不变,t2时再向容器中充入CO、H2各1mol,平衡将 移动(填“向左”、 “向右”或“不”)。t2时,若改变反应条件,导致H2浓度发生如右图t2后所示的变化,则改变的条件可能是 (填符号)。
a加入催化剂 b降低温度 c缩小容器体积 d减少CO2的量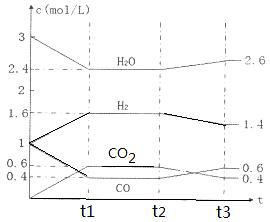
(2)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下: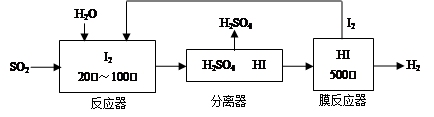
①用离子方程式表示反应器中发生的反应 。
②用化学平衡移动的原理分析,在 HI分解反应中使用膜反应器分离出H2的目的是 。
Ⅲ.开发新能源是解决大气污染的有效途径之一。甲醇燃料电池(简称DMFC)由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注。DMFC工作原理如图所示: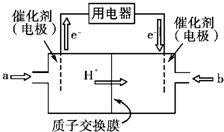
通入a气体的电极是原电池的 (填“正”或“负”),
其电极反应式为 。
I.-1160kJ·mol-1(2分)
II.(1)K=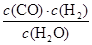 (2分) 右 (2分) b (2分)
(2分) 右 (2分) b (2分)
(2)①SO2+2H2O=H2SO4+H2 (2分) ②降低生成物的浓度,使平衡向正方向移动(2分)
Ⅲ.负(1分) CH3OH﹣6e-+H2O→CO2+6H+(2分)
解析试题分析:Ⅰ.根据已知反应①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574kJ·mol-1、
②CH4(g)+2NO2 (g)=N2(g) + CO2(g)+2H2O(g) △H3=-867kJ·mol-1可知,依据盖斯定律计算②×2-①即得到反应CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g),所以该反应的反应热△H2=-867kJ·mol-1×2+574kJ·mol-1=-1160kJ·mol-1。
Ⅱ.(1)化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据反应的方程式C(s) + H2O(g)= CO(g) + H2(g)可知,该反应的平衡常数K=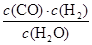 。
。
(2)①t1时CO、H2O、CO2、H2的浓度(mol/L)分别是0.4、2.4、0.6、1.6,则该反应的平衡常数K=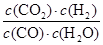 =
=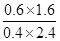 =1。t2时再向容器中充入CO、H2各1mol,此时CO、H2O、CO2、H2的浓度(mol/L)分别是1.4、2.4、0.6、2.6,则
=1。t2时再向容器中充入CO、H2各1mol,此时CO、H2O、CO2、H2的浓度(mol/L)分别是1.4、2.4、0.6、2.6,则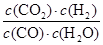 =
= =0.46<1,所以反应向正反应方向移动,即向右移动;根据图像可知,t2时生成物浓度逐渐减小,反应物浓度逐渐增大。由于正方应是体积不变的、吸热的可逆反应,所以改变的条件应该是降低温度,导致平衡向逆反应方向移动,答案选b。
=0.46<1,所以反应向正反应方向移动,即向右移动;根据图像可知,t2时生成物浓度逐渐减小,反应物浓度逐渐增大。由于正方应是体积不变的、吸热的可逆反应,所以改变的条件应该是降低温度,导致平衡向逆反应方向移动,答案选b。
(2①根据流程图可知,SO2首先被单质碘氧化,生成硫酸和碘化氢,碘化氢分解又生成单质碘和氢气,所以反应器中发生的反应的离子方程式可表示为SO2+2H2O=H2SO4+H2。
②碘化氢分解反应是可逆反应,分离出单质氢气,降低生成物的浓度,使平衡向正反应方向移动。
Ⅲ.原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。根据装置图可知,电子从左侧流向右侧,这说明左侧是负极,右侧是正极。所以通入a气体的电极是原电池的负极,通入的是甲醇。由于存在质子交换膜,因此负极电极反应式是CH3OH﹣6e-+H2O→CO2+6H+。
考点:考查反应热的计算;外界条件对平衡状态的影响、平衡常数的计算和应用;燃料电池的判断以及电极反应式的书写等。


科目:高中化学 来源: 题型:填空题
Ⅰ.通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。下表为一些化学键的键能数据
| 化学键 | Si-Si | O=O | Si-O |
| 键能/kJ·mol-1 | a | b | c |
 2NH3(g);△H<0,反应达到平衡后,测得混合气体为7体积。
2NH3(g);△H<0,反应达到平衡后,测得混合气体为7体积。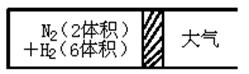
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)合成氨反应的热化学方程式:N2(g)+3H2(g) 2NH3(g)ΔH=-92.2kJ·mol-1
2NH3(g)ΔH=-92.2kJ·mol-1
已知合成氨反应是一个反应物不能完全转化为生成物的反应,在某一定条件下,N2的转化率仅为10%,要想通过该反应得到92.2 kJ的热量,至少在反应混合物中要投放N2的物质的量为________ mol。
(2)肼(N2H4)-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。肼-空气燃料电池放电时:
正极的电极反应式:__________________________,
负极的电极反应式:__________________________。
(3)如图是一个电解过程示意图。
①锌片上发生的电极反应式是:_______________________
②假设使用肼-空气燃料电池作为该过程中的电源,铜片质量变化为128 g,则肼-空气燃料电池理论上消耗标准状况下的空气________L(假设空气中氧气体积分数为20%)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业上利用天然气(主要成分为CH4)与CO2进行高温重整制备CO,已知CH4、H2和CO的燃烧热(ΔH)分别为-890.3 kJ·mol-1、-285.8 kJ·mol-1和-283.0 kJ·mol-1,则生成1 m3(标准状况)CO所需热量为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
磷在自然界常以难溶于水的磷酸盐如Ca3(PO4)2等形式存在。它的单质和化合物有着广泛的应用。
(1)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)。
请回答问题:
①PCl5分解成PCl3和Cl2的热化学方程式是 。
②P和Cl2分两步反应生成1 mol PCl5的△H3= 。
(2)PCl5分解成PCl3和Cl2的反应是可逆反应。T℃时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,经过250 s达到平衡。反应过程中测定的部分数据见下表:
| t / s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3) / mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
2SO2(g)+O2(g)=2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ·mol-1。请回答下列问题: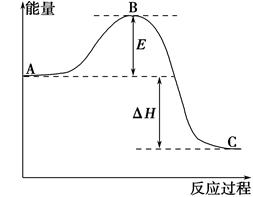
(1)图中A、C分别表示________、________;
(2)E表示________;E的大小对该反应的反应热________(填“有”或“无”)影响。
(3)该反应通常用V2O5作催化剂,加V2O5会使图ΔH________(填“变大”、“变小”或“不变”),理由是______________________________________。
(4)图中ΔH=________kJ·mol-1;
(5)已知单质硫的燃烧热为296 kJ·mol-1,计算由S(s)生成3 mol SO3(g)的ΔH=________(要求计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
将煤转化为水煤气的主要化学反应为C(s)+H2O(g)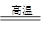 CO(g)+H2(g);C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:
CO(g)+H2(g);C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:
C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
H2(g)+ O2(g)=H2O(g) ΔH=-242.0 kJ·mol-1
O2(g)=H2O(g) ΔH=-242.0 kJ·mol-1
CO(g)+ O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
请回答:
(1)根据以上数据,写出C(s)与水蒸气反应的热化学方程式:________。
(2)比较反应热数据可知,1 mol CO(g)和1 mol H2(g)完全燃烧放出的热量之和比1 mol C(s)完全燃烧放出的热量多。甲同学据此认为“煤转化为水煤气可以使煤燃烧放出更多的热量”;乙同学根据盖斯定律作出下列循环图:
并据此认为“煤转化为水煤气再燃烧放出的热量与煤直接燃烧放出的热量相等”。
请分析:甲、乙两同学观点正确的是________(填“甲”或“乙”);判断的理由是________。
(3)将煤转化为水煤气作为燃料和煤直接燃烧相比有很多优点,请列举其中的两个优点________。
(4)水煤气不仅是优良的气体燃料,也是重要的有机化工原料。CO和H2在一定条件下可以合成:①甲醇;②甲醛;③甲酸;④乙酸。试分析当CO和H2按1:1的体积比混合反应,合成上述________(填序号)物质时,可以满足“绿色化学”的要求,完全利用原料中的原子,实现零排放。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。
请回答下列问题:
(1)煤的气化的主要化学反应方程式为:______________________________________。
(2)煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为:____________________________________________________________。
(3)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)  CH3OH(g)ΔH=-90.8 kJ·mol-1
CH3OH(g)ΔH=-90.8 kJ·mol-1
②2CH3OH(g)  CH3OCH3(g)+H2O(g)ΔH=-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g)ΔH=-23.5 kJ·mol-1
③CO(g)+H2O(g)  CO2(g)+H2(g)ΔH=-41.3 kJ·mol-1
CO2(g)+H2(g)ΔH=-41.3 kJ·mol-1
总反应3H2(g)+3CO(g)  CH3OCH3(g)+CO2(g)的ΔH=________;
CH3OCH3(g)+CO2(g)的ΔH=________;
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是________(填字母代号)。
a.高温高压
b.加入催化剂
c.减少CO2的浓度
d.增加CO的浓度
e.分离出二甲醚
(4)已知反应②2CH3OH(g)??CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol·L-1) | 0.44 | 0.6 | 0.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业制硝酸的主要反应为:4NH3(g)+5O2(g) 4NO(g)+6 H2O(g)△H。
4NO(g)+6 H2O(g)△H。
(1)已知氢气的燃烧热为285.8 kJ/mol。
N2(g)+3H2(g)=2NH3(g) △H=-92.4 kJ/mol;
H2O(1)=H2O(g)△H=+44.0 kJ/mol;
N2(g)+O2(g)=2NO(g)△H=+180.6 kJ/mol。
则上述工业制硝酸的主要反应的△H= 。
(2)在容积固定的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如下表: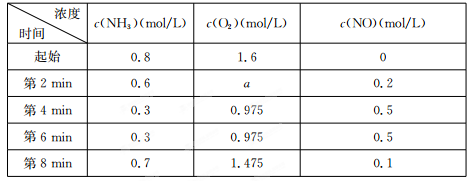
①反应在第2 min到第4 min时,O2的平均反应速率为 。
②反应在第6 min时改变了条件,改变的条件可能是 (填序号)。
A.使用催化剂 B.升高温度 C.减小压强 D.增加O2的浓度
③下列说法中能说明4NH3(g)+5O2(g) 4NO(g)+6 H2 O(g)达到平衡状态的是 (填序号)。
4NO(g)+6 H2 O(g)达到平衡状态的是 (填序号)。
A.单位时间内生成n mol NO的向时,生成n mol NH3
B.条件一定,混合气体的平均相对分子质量不再变化
C.百分含量w(NH3)=w(NO)
D.反应速率v(NH3):u(O2):v(NO):v(H2O)=4:5:4:6
E.若在恒温恒压下容积可变的容器中反应,混合气体的密度不再变化
(3)某研究所组装的CH3OH-O2燃料电池的工作原理如图所示。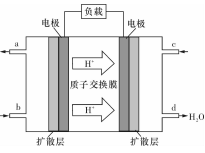
①该电池工作时,b口通入的物质为____ 。
②该电池正极的电极反应式为: 。
③以此电池作电源,在实验室中模拟铝制品表面“钝化”处理(装置如图所示)的过程中,发现溶液逐渐变浑浊并有气泡产生,其原因可能是 (用相关的离子方程式表示)。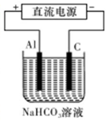
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com