
| A. | 硫酸铵固体中n(NH4+)与n(SO42-) | |
| B. | 相同温度下,0.01mol/L的醋酸溶液与0.02mol/L 醋酸溶液中的c(H+) | |
| C. | 液面均在“0”刻度时,50mL酸式滴定管和25mL酸式滴定管内所盛溶液的体积 | |
| D. | 硫酸铵溶液中,c(NH4+)与c(SO42-) |
分析 A、根据硫酸铵的构成判断;
B、0.01mol/L的醋酸溶液的电离程度大于0.02mol/L 醋酸溶液的电离程度;
C、酸式滴定管最大刻度以下无刻度,但有溶液;
D、硫酸铵中,铵根离子可以过发生水解反应.
解答 解:A.硫酸铵的化学式为(NH4)2SO4,可知固体中n(NH4+)与n(SO42-)为2:1,故A正确;
B.醋酸为弱电解质,浓度不同,电离程度不同,0.01mol/L的醋酸溶液的电离程度大于0.02mol/L 醋酸溶液的电离程度,两溶液中的c(H+)之比小于2:1,故B错误;
C.酸式滴定管最大刻度以下无刻度,但有溶液,故C错误;
D.硫酸铵中,铵根离子可以过发生水解反应,c(NH4+)与c(SO42-)应小于2:1,故D错误.
故选A.
点评 本题考查较为综合,涉及弱电解质的电离、盐类的水解等知识,综合考查学生的分析能力和基础知识的综合运用,为高考常见题型,难度中等.


科目:高中化学 来源: 题型:选择题
 50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1 NaOH溶液进行中和反应,通过测定反应过程中所放出的热量可计算中和热,下列说法正确的是( )
50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1 NaOH溶液进行中和反应,通过测定反应过程中所放出的热量可计算中和热,下列说法正确的是( )| A. | 从实验装置上看,除了缺少环形玻璃搅拌棒外没有其他问题 | |
| B. | 大烧杯上如不盖硬纸板,测得的中和热数值会偏大 | |
| C. | 用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得中和热的数值会偏大 | |
| D. | 实验中改用60 mL 0.50 mol•L-1盐酸跟50 mL 0.55 mol•L-1 NaOH溶液进行反应,与上述实验相比,所放出的热量不相等,但是所求中和热相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
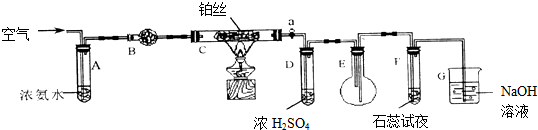
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,35Cl、37Cl之间的关系是同位素.
,35Cl、37Cl之间的关系是同位素.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为NA | |
| B. | 常温常压下,1.06g Na2CO3含有的Na+离子数为0.01NA | |
| C. | 通常状况下,NA个CO2分子占有的体积约为22.4L | |
| D. | 氧气和臭氧的混合物16 g中约含有NA个氧原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可与活泼金属发生取代反应制取氢气 | |
| B. | 不是乙醛的同分异构体 | |
| C. | 可由乙烯通过加成反应制取 | |
| D. | 通过取代反应可制取乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “垃圾不落地,台州更美丽” | B. | 太阳能热水器代替燃气热水器 | ||
| C. | 杜绝使用一切燃料 | D. | 环保袋代替一次性塑料袋 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com