
 现有一瓶浓度为0.2mol/L的某酸溶液,可能为醋酸、盐酸、硫酸中的一种.
现有一瓶浓度为0.2mol/L的某酸溶液,可能为醋酸、盐酸、硫酸中的一种.

 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案科目:高中化学 来源: 题型:
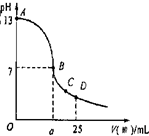
(5分)现有一瓶浓度为0.2 mol/L的某酸溶液,可能为醋酸、盐酸、硫酸中的一种。为了确定该酸溶液的组成进行实验:取25.00 mL0.1 mol/L的氢氧化钠溶液,逐滴加入该酸溶液,恰好反应完全时所需该酸溶液体积为12.50 mL。请回答:
(1)该酸不可能是 ;
(2)用pH试纸测得反应后所得溶液呈碱性,根据此现象说明该酸溶液为 ,用离子方程式说明溶液呈碱性的原因 ;
(3)实验中滴定曲线如右图,在B点,a 12.5(填大于、小于或等于)在C点各离子浓度由大到小排序 。
查看答案和解析>>
科目:高中化学 来源:2010年北京市八一中学高二第二学期期末考试化学试卷 题型:填空题
(5分)现有一瓶浓度为0.2 mol/L的某酸溶液,可能为醋酸、盐酸、硫酸中的一种。为了确定该酸溶液的组成进行实验:取25.00 mL0.1 mol/L的氢氧化钠溶液,逐滴加入该酸溶液,恰好反应完全时所需该酸溶液体积为12.50 mL。请回答:
(1)该酸不可能是 ;
(2)用pH试纸测得反应后所得溶液呈碱性,根据此现象说明该酸溶液为 ,用离子方程式说明溶液呈碱性的原因 ;
(3)实验中滴定曲线如右图,在B点,a 12.5(填大于、小于或等于)在C点各离子浓度由大到小排序 。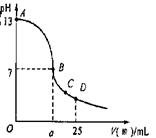
查看答案和解析>>
科目:高中化学 来源:2010年北京市高二第二学期期末考试化学试卷 题型:填空题
(5分)现有一瓶浓度为0.2 mol/L的某酸溶液,可能为醋酸、盐酸、硫酸中的一种。为了确定该酸溶液的组成进行实验:取25.00 mL0.1 mol/L的氢氧化钠溶液,逐滴加入该酸溶液,恰好反应完全时所需该酸溶液体积为12.50 mL。请回答:
(1)该酸不可能是 ;
(2)用pH试纸测得反应后所得溶液呈碱性,根据此现象说明该酸溶液为 ,用离子方程式说明溶液呈碱性的原因 ;
(3)实验中滴定曲线如右图,在B点,a 12.5(填大于、小于或等于)在C点各离子浓度由大到小排序 。

查看答案和解析>>
科目:高中化学 来源: 题型:
(1)该酸不可能是________________;
(2)用pH试纸测得反应后所得溶液呈碱性,根据此现象说明该酸溶液为__________________,用离子方程式说明溶液呈碱性的原因_______________________________________________;
(3)反应后所得溶液中离子浓度由大到小的顺序是____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
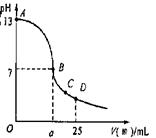
现有一瓶浓度为0.2 mol/L的某酸溶液,可能为醋酸、盐酸、硫酸中的一种。为了确定该酸溶液的组成进行实验:取25.00 mL0.1 mol/L的氢氧化钠溶液,逐滴加入该酸溶液,恰好反应完全时所需该酸溶液体积为12.50 mL。请回答:
(1)该酸不可能是 ;
(2)用pH试纸测得反应后所得溶液呈碱性,根据此现象说明该酸溶液为 ,用离子方程式说明溶液呈碱性的原因 ;
(3)实验中滴定曲线如右图,在B点,a 12.5(填大于、小于或等于)在C点各离子浓度由大到小排序 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com