
| |||||||||||||||||||||||||||||||||
科目:高中化学 来源:吉林省长春外国语学校2011-2012学年高二下学期期末考试化学试题 题型:022
(1)熔点沸点HF________HI;原因:________.
(2)各种含氧酸HClO、HClO3、H2SO3、HClO4的酸性由强到弱排列为________.
(3)下列4种物质熔点沸点由高到低排列为________(填序号).
①金刚石(C-C)②锗(Ge-Ge)
③晶体硅(Si-Si)④金刚砂(Si-C)
(4)晶体具有规则的几何外形,晶体中最基本的重复单元称之为晶胞.NaCl晶体结构如下图所示.晶体中每个Na+同时吸引着________个Cl-,由这些Cl-构成的几何构型为________晶体中在每个Cl-周围与它最接近且距离相等的Cl-共有________个.

(5)某元素的激发态原子的电子排布式为1s22s22p63s23p34s1,则该元素基态原子的电子排布式为________;其最高价氧化物对应的水化物的化学式是________.
(6)某元素原子的价电子构型为3d104S2,它属于第________周期,是________族,________区元素,元素符号是________.该原子核外有________个能级,电子云的形状有________种.
查看答案和解析>>
科目:高中化学 来源:2011-2012学年吉林省长春外国语学校高二下学期期末考试化学试卷(带解析) 题型:填空题
(1)、熔点沸点HF HI;原因:
(2)、各种含氧酸HClO、HClO3、H2SO3、HClO4的酸性由强到弱排列为
(3)、下列4种物质熔点沸点由高到低排列为________ (填序号)
①金刚石(C—C)②锗(Ge—Ge)
③晶体硅(Si—Si)④金刚砂(Si—C)
(4)晶体具有规则的几何外形,晶体中最基本的重复单元称之为晶胞。NaCl晶体结构如图所示。
晶体中每个Na+同时吸引着______个Cl-,由这些 Cl-构成的几何构型为 晶体中在每个Cl-周围与它最接近且距离相等的Cl-共有________个。
(5)某元素的激发态原子的电子排布式为1s 2s
2s 2p
2p 3s
3s 3p
3p 4s
4s ,则该元素基态原子的电子排布式为 ;其最高价氧化物对应的水化物的化学式是
,则该元素基态原子的电子排布式为 ;其最高价氧化物对应的水化物的化学式是
(6)某元素原子的价电子构型为3d104S2,它属于第 周期,是 族, 区元素,元素符号是 。该原子核外有 个能级,电子云的形状有 种
查看答案和解析>>
科目:高中化学 来源:2013届吉林省高二下学期期末考试化学试卷(解析版) 题型:填空题
(1)、熔点沸点HF HI;原因:
(2)、各种含氧酸HClO、HClO3、H2SO3、HClO4的酸性由强到弱排列为
(3)、下列4种物质熔点沸点由高到低排列为________ (填序号)
①金刚石(C—C)②锗(Ge—Ge)
③晶体硅(Si—Si)④金刚砂(Si—C)
(4)晶体具有规则的几何外形,晶体中最基本的重复单元称之为晶胞。NaCl晶体结构如图所示。

晶体中每个Na+同时吸引着______个Cl-,由这些 Cl-构成的几何构型为 晶体中在每个Cl-周围与它最接近且距离相 等的Cl-共有________个。
(5)某元素的激发态原子的电子排布式为1s 2s
2s 2p
2p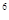 3s
3s 3p
3p 4s
4s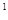 ,则该元素基态原子的电子排布式为
;其最高价氧化物对应的水化物的化学式是
,则该元素基态原子的电子排布式为
;其最高价氧化物对应的水化物的化学式是
(6)某元素原子的价电子构型为3d104S2,它属于第 周期,是 族, 区元素,元素符号是 。该原子核外有 个能级,电子云的形状有 种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com