
分析 (1)分子数之比等于其物质的量之比;根据分子数之比及二者化学式计算出含有原子数之比;
(2)根据n=$\frac{m}{M}$计算出水的物质的量,从而可知硫酸的物质的量,再根据m=nM计算出硫酸的质量;根据二者的分子数相同可知其物质的量相等,据此结合其化学式计算出含有氧原子数、氢原子数之比;
(3)根据n=$\frac{V}{{V}_{m}}$计算出二氧化碳的物质的量,再根据m=nM计算出质量;最后结合二氧化碳的化学式计算出含有氧原子的物质的量及数目;
(4)根据n=cV计算出氢氧化钠的物质的量,再根据m=nM计算出其质量;
(5)根据n=$\frac{V}{{V}_{m}}$计算出氨气的物质的量,再根据c=$\frac{n}{V}$计算出所得溶液的浓度.
解答 解:(1)根据N=nNA可知,3mol的CO2与2mol的SO2的分子数比=n(CO2):n(SO2)=3mol:2mol=3:2;原子数比是为:(3×3):(2×3)=3:2,
故答案为:3:2;3:2;
(2)3.6g水的物质的量为:$\frac{3.6g}{18g/mol}$=0.2mol,由于分子数相同,则硫酸的物质的量为0.2mol,质量为:98g/mol×0.2mol=19.6g;
由于二者的分子数相同,则物质的量相等,它们所含氧原子数之比是:(1×1):(1×4)=1:4;其中氢原子数之比是:(1×2):(1×2)=1:1,
故答案为:19.6;1:4;1:2;
(3)标况下,6.72L CO2的物质的量为:$\frac{6.72L}{22.4L/mol}$=0.3mol;0.3mol二氧化碳的质量为:44g/mol×0.3mol=13.2g;0.3mol二氧化碳分子中含0.6mol氧原子,含有氧原子的个数为0.6NA,
故答案为:0.3mol;13.2g;0.6NA;
(4)100ml 1mol/LNaOH溶液中所含NaOH的物质的量为:1mol/L×0.1L=0.1mol,0.1molNaOH的质量为:40g/mol×0.1mol=4.0g,
故答案为:0.1mol;4.0g;
(5)标况下11.2LNH3(氨气)的物质的量为:$\frac{11.2L}{22.4L/mol}$=0.5mol,所得溶液的浓度为:$\frac{0.5mol}{0.5L}$=1mol/L,
故答案为:1mol/L.
点评 本题考查了物质的量与浓度、气体摩尔体积的综合应用,题目难度中等,明确物质的量与摩尔质量、物质的量浓度、气体摩尔体积等之间的关系为解答关键,试题知识点较多、综合性较强,充分考查了学生的化学计算能力.


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在18g18O2中含有NA个氧原子 | |
| B. | 标准状况下,22.4L空气中含有2NA个氢原子 | |
| C. | 1molCl2参加反应转移电子数一定为2NA | |
| D. | 含NA个Na+的NaOH溶解于lL水中,Na+的物质的量浓度为1mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
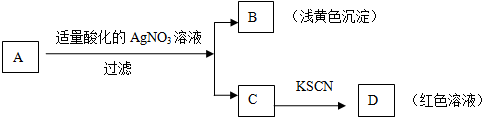
| A. | 盐A一定是FeBr3 | B. | 浅黄色沉淀B是AgBr | ||
| C. | 滤液C中一定含Fe 3+ | D. | D溶液中有Fe(SCN)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
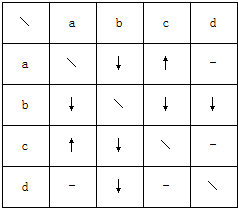
| A. | a可能是NaHCO3溶液 | B. | b一定是Ba(OH)2溶液 | ||
| C. | c一定是稀硫酸 | D. | d一定是MgCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2既是氧化剂,又是还原剂 | |
| B. | 还原产物与氧化产物的物质的量之比为5:1 | |
| C. | 当转移了3 mol电子时,反应消耗了3 mol的Cl2 | |
| D. | 反应中NaOH提供了碱性环境,但它既不是氧化剂也不是还原剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com