
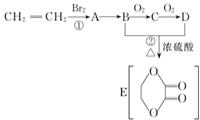
 由乙烯和其他无机原料合成环状酯,其合成过程如下(水及其他无机产物均已省略)
由乙烯和其他无机原料合成环状酯,其合成过程如下(水及其他无机产物均已省略)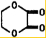 +2H2O.
+2H2O. 分析 CH2=CH2和溴发生加成反应,生成A为CH2BrCH2Br,B能连续被氧化生成D,B和D能发生酯化反应生成E,根据E结构简式知,B为CH2OHCH2OH,氧化产物C为OHC-CHO,D为HOOC-COOH,则A发生水解反应生成B,结合有机物的结构和性质可解答该题.
解答 解:CH2=CH2和溴发生加成反应,生成A为CH2BrCH2Br,B能连续被氧化生成D,B和D能发生酯化反应生成E,根据E结构简式知,B为CH2OHCH2OH,氧化产物C为OHC-CHO,D为HOOC-COOH,则A发生水解反应生成B,
(1)由以上分析可知,①为CH2=CH2和溴发生加成反应,②为BCH2OHCH2OH与DHOOC-COOH发生酯化反应或取代反应,故答案为:加成反应;酯化反应或取代反应;
(2)由以上分析可知,D为HOOC-COOH,其中的官能团名称为羧基,故答案为:羧基;
(3)A为CH2BrCH2Br,对应的同分异构体为CH3-CHBr2,故答案为:CH3-CHBr2;
(4)A和氢氧化钠的水反应发生取代反应生成B,反应方程式为:CH2BrCH2Br+2H2O$→_{△}^{NaOH}$HOCH2CH2OH+2HBr;
B和D发生酯化反应生成D,反应方程式为CH2OHCH2OH+HCOOC-COOH$?_{△}^{浓硫酸}$ +2H2O,
+2H2O,
故答案为:CH2BrCH2Br+2H2O$→_{△}^{NaOH}$HOCH2CH2OH+2HBr;CH2OHCH2OH+HCOOC-COOH$?_{△}^{浓硫酸}$ +2H2O.
+2H2O.
点评 本题考查有机物推断,为高频考点,明确官能团及其性质关系是解本题关键,根据官能团结合反应条件进行推断,知道常见物质结构和性质,题目难度不大.


 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③⑤⑥⑧ | B. | ①②④⑦ | C. | ③⑤ | D. | ③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上第一次月考化学卷(解析版) 题型:选择题
某温度时,在2L容器中三种物质的物质的量随时间的变化曲线如图所示。由图中数据分析,该反应的化学方程式和反应开始至2min末Z的平均反应速率分别为 ( )

A. X+3Y=2Z 0.1mol·min—1
B.2X+Y 2Z 0.1mol·min—1
2Z 0.1mol·min—1
C.X+2Y=Z 0.05mol·min—1
D.3X+Y 2Z 0.05mol·min—1
2Z 0.05mol·min—1
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4L 0.5 mol/L NaCl 溶液 | B. | 1L 0.3 mol/L Na2SO4 溶液 | ||
| C. | 0.8L 0.4 mol/L NaOH 溶液 | D. | 2L 0.15 mol/L Na3PO4 溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 氢氰酸(HCN) | 碳酸(H2CO3) | 氢氟酸(HF) |
| K=6.2×10-10 | Ka1=4.2×10-7 | K=6.61×10-4 |
| A. | 氟化钠溶液中通入CO2:2F-+H2O+CO2═2HF+CO32- | |
| B. | NaCN与HCN的混合溶液中:2c(Na+)═c(CN-)+c(HCN) | |
| C. | 0.2 mol•L-1 HCN溶液与0.1mol•L-1NaOH溶液等体积混合后,溶液的pH>7 | |
| D. | 25℃时同浓度的NaCN和NaF溶液的pH值前者小于后者 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | α2=α3<α4<α1 | B. | α3=α2<α1<α4 | C. | α2<α3<α1<α4 | D. | α1<α2<α3<α4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去CO2中混有的HCl:用碳酸钠溶液洗气 | |
| B. | 通过碱石灰固体除去SO2中的水蒸气 | |
| C. | 除去氯化钠中混有的氯化铵:用加热法 | |
| D. | 除去NaHCO3中混有的Na2CO3:用加热法 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
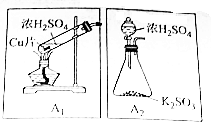 二氧化硫(SO2)是中学化学中常见的气体,在生产生活中用途广泛,某化学课题小组对其进行了实验探究,方案如下:
二氧化硫(SO2)是中学化学中常见的气体,在生产生活中用途广泛,某化学课题小组对其进行了实验探究,方案如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com