
 (1)将反应2H2(g)+O2(g)=2H2O(1)△H<0,以KOH溶液为电解质溶液,设计一个原电池,其负极反应为:
(1)将反应2H2(g)+O2(g)=2H2O(1)△H<0,以KOH溶液为电解质溶液,设计一个原电池,其负极反应为:
| ||
| ||


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
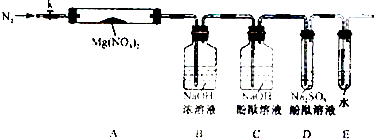 固体硝酸盐加热易分解且产物较复杂.某学习小组以Mg(NO3)2为研究对象,拟通过实验探究其热分解的产物,提出如下4种猜想:
固体硝酸盐加热易分解且产物较复杂.某学习小组以Mg(NO3)2为研究对象,拟通过实验探究其热分解的产物,提出如下4种猜想:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(Cu2+)增大 |
| B、c(Cu2+)减小 |
| C、c(Cu2+)不变 |
| D、无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、所有自发进行的化学反应都是放热反应 |
| B、自发过程将导致体系的熵增大 |
| C、△H-T△S<0反应能自发进行 |
| D、同一物质的固、液、气三种状态的熵相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,0.1NA个HCl分子的体积为2.24L |
| B、标准状况下,22.4L 氖气含有2NA 个原子 |
| C、1L 0.2mol/L 硫酸铁溶液中含有的SO42- 离子数目为0.2 NA |
| D、1 mol氖中含有的电子数为10NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com