
 COOH
COOH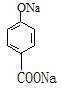 ,故答案为:
,故答案为: ;
;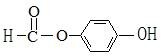 (邻,间等);②醛类符合条件的结构简式为:
(邻,间等);②醛类符合条件的结构简式为: ,故答案为:
,故答案为: (邻,间等);
(邻,间等); .
.


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
 所示,则下列有关说法正确的是(双选)
所示,则下列有关说法正确的是(双选)
 ,在一定条件下,化合物Ⅲ也能与CO2发生类似于化合物C与CO2反应生成D的反应,生成两种化合物(互为同分异构体),写出其中任意一种化合物的结构简式:
,在一定条件下,化合物Ⅲ也能与CO2发生类似于化合物C与CO2反应生成D的反应,生成两种化合物(互为同分异构体),写出其中任意一种化合物的结构简式:查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验操作 | 实验目的 | |
| A | 苯和溴水混合后加入铁粉 | 制溴苯 |
| B | 某有机物与溴的四氯化碳溶液混合 | 确认该有机物含碳碳双键 |
| C | 乙醇与重铬酸钾(K2Cr2O7)酸性溶液混合 | 乙醇具有还原性 |
| D | 将溴乙烷与氢氧化钠水溶液共热一段时间,冷却,向其中滴加硝酸银溶液 | 检验溴乙烷中的溴原子 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH4和C2H6 |
| B、CH2=CH2和CH≡CH |
| C、CH3CH2CH3和CH2=CHCH3 |
| D、CH2=CHCH2CH3和CH3CH=CHCH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 2min | 4min | 6min | 8min | … | |
| CO | 0.07 | 0.06 | 0.06 | 0.05 | … |
| H2 | x | 0.12 | 0.12 | 0.20 | … |
| CH3OH | 0.03 | 0.04 | 0.04 | 0.05 | … |
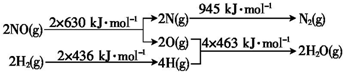 H2还原NO生成氮气和水蒸气的热化学方程式是
H2还原NO生成氮气和水蒸气的热化学方程式是查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| △ |
| 催化剂 |
| △ |
| 催化剂 |
| △ |
| 催化剂 |
| △ |
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| c(H+) | 6.3×10-9 | 6.3×10-8 | 6.3×10-7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com