
为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以A1作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。反应原理如下:电池:Pb(s)+ PbO2(s)+2H2SO4(aq)= 2PbSO4(s)+ 2H2O(l)
电解池:2Al + 3H2O  Al2O3 + 3H2↑,电解过程中,以下判断正确的是( )
Al2O3 + 3H2↑,电解过程中,以下判断正确的是( )
| | 原电池 | 电解池 |
| A | H+移向Pb电极 | H+移向Pb电极 |
| B | 每消耗3molPb | 生成2molAl2O3 |
| C | 正极:PbO2+4H++2e-=Pb2++2H2O | 阳极:2Al+3H2O-6e-=Al2O3+6H+ |
| D |  |  |
D
解析试题分析:A.根据同种电荷相互排斥,异种电荷相互吸引的原则,在原电池中,H+移向PbO2电极;在电解池H+移向Pb电极。错误。B.每消耗3molPb,电子转移6mol,由于在同一闭合回路中电子转移数目相等。所以在电解池中生成1molAl2O3.错误。C. 在原电池的正极发生反应PbO2+4H++2e-+SO42-=PbSO4+2H2O;在电解池阳极:2Al+3H2O-6e-=Al2O3+6H+。错误。D.在原电池中由于负极的变化为Pb→PbSO4.所以Pb电解质量增加。在电解池中,Pb作阴极,不参与氧化还原反应,所以其质量不发生变化。正确。
考点:考查原电池、电解池的工作原理的知识。


科目:高中化学 来源: 题型:单选题
图甲中电极均为石墨电极,下列叙述中正确的是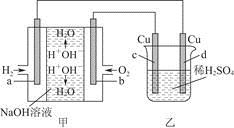
| A.电子沿a→d→c→d路径流动 |
| B.b极的电极反应为O2+4e-+4H+=2H2O |
C.通电初期乙中的总反应为Cu+H2SO4  CuSO4+H2↑ CuSO4+H2↑ |
| D.反应过程中,甲、乙装置中溶液的pH都逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
将下图所示实验装置的K闭合,下列判断正确的是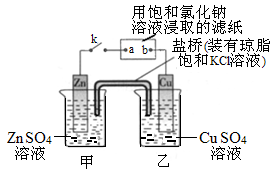
| A.Zn电极上发生还原反应 |
| B.片刻后盐桥中的Cl-向乙装置中移动 |
| C.片刻后在a点滴加酚酞观察到滤纸变红色 |
| D.片刻后在b点滴加淀粉碘化钾溶液观察到滤纸无变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
如图为一种微生物燃料电池结构示意图,关于该电池叙述正确的是
| A.分子组成为Cm(H2O)n的物质一定是糖类 |
| B.微生物所在电极区放电时发生还原反应 |
| C.放电过程中,H+从正极区移向负极区 |
| D.正极反应式为:MnO2+4H++2e—=Mn2++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
控制适合的条件,将反应2Fe3++2I- 2Fe2++I2设计成如下图所示的原电池。下列判断不正确的是
2Fe2++I2设计成如下图所示的原电池。下列判断不正确的是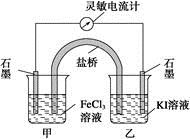
| A.反应开始时,乙中石墨电极上发生氧化反应 |
| B.反应开始时,甲中石墨电极上Fe3+被还原 |
| C.电流计读数为零时,反应达到化学平衡状态 |
| D.电流计读数为零后,在甲中溶入FeCl2固体,乙中的石墨电极为负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH。关于该电池的说法正确的是( )
3Zn(OH)2+2Fe(OH)3+4KOH。关于该电池的说法正确的是( )
| A.放电时,Zn作负极,发生还原反应 |
| B.放电时,K2FeO4附近溶液pH减小 |
| C.充电时,锌极附近溶液pH减小 |
| D.充电时,阳极电极反应为: |
 +4H2O
+4H2O查看答案和解析>>
科目:高中化学 来源: 题型:单选题
[双选题]烧杯A中盛放0.1 mol·L-1的H2SO4溶液,烧杯B中盛放0.1 mol·L-1的
CuCl2溶液(两种溶液均足量),装置如图所示,下列说法不正确的是( )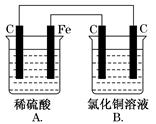
| A.A为原电池,B为电解池 |
| B.A为电解池,B为原电池 |
| C.当A烧杯中产生0.1 mol气体时,B烧杯中产生气体的物质的量也为0.1 mol |
| D.一段时间后,B烧杯中溶液的浓度增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某种氢氧燃料电池的电解液为KOH溶液,下列有关该电池的叙述不正确的是( )
| A.正极反应式为:O2+2H2O+4e-=4OH- |
| B.工作一段时间后,电解液中KOH的物质的量不变 |
| C.该燃料电池的总反应方程式为:2H2+O2=2H2O |
| D.用该电池电解CuCl2溶液,产生2.24 L Cl2(标准状况)时,有0.1 mol电子转移 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com