
| A. | 4:5 | B. | 5:4 | C. | 2:7 | D. | 2:1 |
分析 左室中氮气的物质的量不变,令开始氮气的物质的量为1mol,左右两室压强相同,体积之比等于物质的量之比,据此计算开始右室中氢气与氧气的物质的量,反应后左右体积相等,则右室剩余气体的物质的量为1mol,该气体可能是氧气或氢气,根据差量法计算,原混合气体中氢气、氧气的物质的量,进而计算体积比.
解答 解:左室中氮气的物质的量不变,令开始氮气的物质的量为1mol,左右两室压强相同,体积之比等于物质的量之比,故开始右室中氢气与氧气的物质的量为1mol×$\frac{\frac{3}{4}}{\frac{1}{4}}$=3mol,反应后左右体积相等,则右室剩余气体的物质的量为1mol,则:
2H2+O2=2H2O 气体物质的量减少△n
2 1 3
$\frac{4}{3}$mol $\frac{2}{3}$mol 3mol-1mol=2mol
若剩余气体为氢气,则原混合气体中氧气为$\frac{2}{3}$mol,则氢气为3mol-$\frac{2}{3}$mol=$\frac{7}{3}$mol,H2和O2的体积比为$\frac{7}{3}$mol:$\frac{2}{3}$mol=7:2,
若剩余气体是氧气,则原混合气体中氢气为 $\frac{4}{3}$mol,则氢气为3mol-$\frac{4}{3}$mol=$\frac{5}{3}$mol,H2和O2的体积比为 $\frac{4}{3}$mol:$\frac{5}{3}$mol=4:5,
故选A.
点评 本题考查化学方程式的计算,题目难度中等,根据左室氮气的物质的量利用体积判断右室气体的物质的量是关键,试题培养了学生的化学计算能力.


 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:选择题
| ① | ② | |
| A | 无明显现象 | 只有AgBr沉淀生成 |
| B | 生成淡黄色沉淀 | AgCl和AgBr沉淀都有,但AgCl沉淀更多 |
| C | 无明显现象 | AgCl和AgBr沉淀都有,但AgCl沉淀更多 |
| D | 生成黄色沉淀 | AgCl和AgBr沉淀都有,但AgBr沉淀更多 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将0.1mol氨充分溶解在1L水中 | |
| B. | 将10g质量分数为98%的硫酸与990g水混合 | |
| C. | 将10mL•1mol•L-1的盐酸与90mL水充分混合 | |
| D. | 将25.0g胆矾(CuSO4•5H2O)溶于水配成1L溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
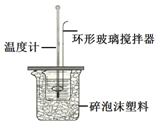 测定稀盐酸和稀氢氧化钠中和热的实验装置如图所示.(中和热:在稀溶液中,酸跟碱发生中和反应生成1mol水时的反应热)
测定稀盐酸和稀氢氧化钠中和热的实验装置如图所示.(中和热:在稀溶液中,酸跟碱发生中和反应生成1mol水时的反应热)| 温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
| HCl | NaOH | ||
| 1 | 26.1 | 26.1 | 29.3 |
| 2 | 25.9 | 25.9 | 29.0 |
| 3 | 26.3 | 26.3 | 29.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在浓度大的盐酸中反应产生的气体多 | |
| B. | 一样多 | |
| C. | 在浓度小的盐酸中反应产生的气体多 | |
| D. | 由反应的剧烈程度决定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 酸 | HClO2 | H2CO3 | HClO |
| Ka | 1×10-2 | K1=4.3×10-7、K2=5.6×10-11 | 3×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碘酒可使蛋白质变性,故能消毒杀菌 | |
| B. | 天然氨基酸能溶于强酸或强碱溶液,在两性化合物 | |
| C. | 常温下,强酸和弱酸的浓度相同时,强酸中水的电离程度比弱酸中的大 | |
| D. | 船舶外壳装上锌块,是牺牲阳极的阴极保护法进行防腐 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com