
| A. | HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和NaOH完全反应的中和热为-114.6kJ/mol | |
| B. | CO(g)的燃烧热是283.0kJ/mol,则表示CO燃烧热的热化学方程式为2CO(g)+O2(g)═2CO2(g);△H=-283.0kJ/mol | |
| C. | 一个化学反应的热效应,只与反应的始态与终态有关,与反应的过程无关 | |
| D. | 需要加热才能发生的反应一定是吸热反应 |
分析 A.中和热与生成水的物质的量多少无关,2SO4和NaOH完全反应的中和热与HCl和NaOH反应的中和热相同,都是△H=-57.3kJ/mol;
B.燃烧热中CO的物质的量为1mol,反应热与化学计量数成正比,则2molCO完全燃烧放出的热量为566kJ;
C.根据盖斯定律可知,反应热只与反应体系的始态和终态有关;
D.反应热与反应条件没有必然关系,则需要加热才能发生的反应不一定是吸热反应,如铝热反应.
解答 解:A.HCl和NaOH反应的中和热△H=-57.3kJ/mol,由于中和热与生成水的物质的量多少无关,则H2SO4和NaOH完全反应的中和热也是△H=-57.3kJ/mol,故A错误;
B.CO(g)的燃烧热是283.0kJ/mol,则表示CO燃烧热的热化学方程式为2CO(g)+O2(g)═2CO2(g);△H=-566.0kJ/mol,故B错误;
C.反应热等于生成物的总能量减去反应物的总能量,只与反应体系的始态和终态有关,而与反应的途径无关,故C正确;
D.需要加热才能发生的反应不一定是吸热反应,如铝热反应为放热反应,铝热反应需要在加热条件下才能进行,故D错误;
故选C.
点评 本题考查了热化学方程式的书写及应用,题目难度中等,明确化学反应与能力变化的关系为解答关键,注意熟练掌握热化学方程式的概念及书写原则,试题有利于提高学生的分析能力及灵活应用基础知识的能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MgCl2(熔融)$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑ | B. | Al2O3+3H2$\frac{\underline{\;\;△\;\;}}{\;}$2Al+3H2O | ||
| C. | Fe3O4+4CO$\frac{\underline{\;\;△\;\;}}{\;}$3Fe+4CO2 | D. | 2HgO$\frac{\underline{\;\;△\;\;}}{\;}$2Hg+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
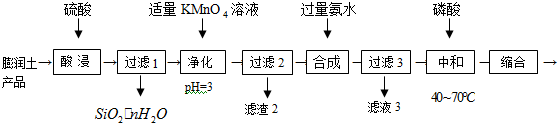
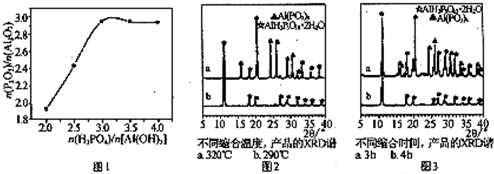
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
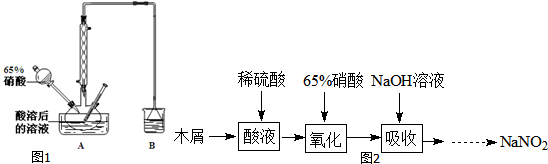
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2LiH(s)+O2(g)═Li2O(s)+H2O(l)△H=-702 kJ•mol-1 | |
| B. | 2LiH(s)+O2(g)═Li2O(s)+H2O(l)△H=-1 950 kJ•mol-1 | |
| C. | 2LiH(s)+O2(g)═Li2O(s)+H2O(l)△H=-1 586 kJ•mol-1 | |
| D. | 2LiH(s)+O2(g)═Li2O(s)+H2O(g)△H=-988 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 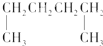 1.4-二甲基丁烷 1.4-二甲基丁烷 | B. | 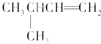 3-甲基丁烷 3-甲基丁烷 | ||
| C. | 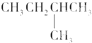 2-甲基丁烷 2-甲基丁烷 | D. | CH2Cl-CH2Cl 二氯乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
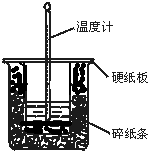 50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1NaOH溶液在图示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1NaOH溶液在图示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S区、第五周期、ⅠA族 | B. | ds区、第五周期、ⅠB族 | ||
| C. | d区、第四周期、ⅠB族 | D. | ds区、第五周期、ⅠA族 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com