
|
在某温度下,将2 mol A和3 mol B充入一密闭容器中,发生如下可逆反应:aA(g)+B(g) | |
A. |
60% |
B. |
24% |
C. |
4% |
D. |
40% |
 优等生题库系列答案
优等生题库系列答案科目:高中化学 来源: 题型:
 氮的氧化物和SO2是常见的化工原料,但也是大气的主要污染物.综合治理其污染是化学家研究的主要内容.根据题意完成下列各题:
氮的氧化物和SO2是常见的化工原料,但也是大气的主要污染物.综合治理其污染是化学家研究的主要内容.根据题意完成下列各题:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

(1)若以A点表示
(2)将pH=8的Ba(OH)2溶液与pH=5的稀盐酸混合,并保持
(3)已知AnBm的离子积=[c(Am+)]n·[c(Bn-)]m,式中c(Am+)和c(Bn-)表示离子的物质的量浓度。在某温度下Ca(OH)2的溶解度为
查看答案和解析>>
科目:高中化学 来源: 题型:
(16分)甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ: CO(g) +2H2(g) CH3OH(g) ΔH1
反应Ⅱ: CO2(g) + 3H2(g) CH3OH(g) + H2O(g) ΔH2
①反应Ⅱ的平衡常数表达式是 。
②下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
W$w#w..c.o*m由表中数据判断ΔH1 0 (填“>”、“=”或“<”)。
③某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)= 0.2 mol/L,则CO的转化率为 。
(2)已知在常温常压下:
① 2CH3OH(l)+ 3O2(g)= 2CO2(g)+ 4H2O(g) ΔH1 = -1275.6 kJ/mol
② 2CO (g)+ O2(g)= 2CO2(g) ΔH2 = -566.0 kJ/mol
③H2O(g) = H2O(l) ΔH3 = -44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式: 。
(3)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置。该电池正极的电极反应为 。
查看答案和解析>>
科目:高中化学 来源:2010年广东省广州东莞五校高三上学期第二次联考(理综)化学 题型:填空题
(16分)甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ: CO(g) +
2H2(g)  CH3OH(g)
ΔH1
CH3OH(g)
ΔH1
反应Ⅱ: CO2(g) + 3H2(g)  CH3OH(g) + H2O(g)
ΔH2
CH3OH(g) + H2O(g)
ΔH2
①反应Ⅱ的平衡常数表达式是 。
②下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
|
温度 |
250℃ |
300℃ |
350℃ |
|
K |
2.041 |
0.270 |
0.012 |
W$w#w..c.o*m由表中数据判断ΔH1 0 (填“>”、“=”或“<”)。
③某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)= 0.2 mol/L,则CO的转化率为 。
(2)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH1 = -1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH2 = -566.0 kJ/mol
③H2O(g) = H2O(l) ΔH3 = -44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式: 。
(3)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置。该电池正极的电极反应为 。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮的氧化物和SO2是常见的化工原料,但也是大气的主要污染物.综合治理其污染是化学家研究的主要内容.根据题意完成下列各题:
氮的氧化物和SO2是常见的化工原料,但也是大气的主要污染物.综合治理其污染是化学家研究的主要内容.根据题意完成下列各题: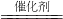 2SO3(g);SO2的平衡转化率与体系总压强的关系如图1所示.某温度下,将2.0mol SO2和1.0mol O2置于30L刚性密闭容器中,30秒反应达平衡后,体系总压强为2.70MPa.用氧气表示该反应的平均速率是______mol?L-1?min-1.
2SO3(g);SO2的平衡转化率与体系总压强的关系如图1所示.某温度下,将2.0mol SO2和1.0mol O2置于30L刚性密闭容器中,30秒反应达平衡后,体系总压强为2.70MPa.用氧气表示该反应的平均速率是______mol?L-1?min-1.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com