
(9��)��ͼ��һ������ȼ�ϵ�ع���ʱ��ʾ��ͼ���ҳ��е������缫һ����ʯī�缫��һ�������缫������ʱM��N�����缫�������������٣���ش��������⣺

��1��N�ĵ缫��ӦʽΪ ��
�ҳص��ܻ�ѧ����ʽ�� ��
�������IJ��缫�ĵ缫��ӦʽΪ ��
��2���ڴ˹����У��ҳ���ijһ�缫����������4��32gʱ���׳�����������������Ϊ L����״���£�������ʱ�ҳ���Һ�����Ϊ200mL�����ҳ�����Һ��H+��Ũ��Ϊ ��
��1��4OH--4e-=O2��+2H2O��1�֣���
4AgNO3+2H2O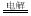 4Ag+4HNO3+2O2��(2��)��
4Ag+4HNO3+2O2��(2��)��
CH4-8e-+10OH-=CO32-+7H2O(2��)
��2��0��224(2��)��0��2mol/L(2��)
��������
�����������1���׳���������������ҺΪ���Һ�ļ���ȼ�ϵ�أ�ͨ������һ��Ϊԭ��صĸ������缫��ӦʽΪ��CH4-8e-+10OH-=CO32-+7H2O��ͨ��������һ��Ϊԭ��ص��������缫��ӦʽΪ��O2 + 2H2O + 4e-=4OH-���ҳ�Ϊ���أ��ҳ��е������缫һ����ʯī�缫��һ�������缫������ʱM��N�����缫�������������٣�N����ԭ��ص�������Ϊ���ص�������ӦΪʯī���ϣ�NΪ�������缫��Ӧʽ��4OH--4e-=O2��+2H2O��MΪ�������缫��ӦʽΪAg++e-=Ag�������ܷ�ӦΪ��4AgNO3+2H2O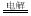 4Ag+4HNO3+2O2������2��n��Ag��=0.04mol������Ag++e-=Ag��֪ת�Ƶ���Ϊ0.04mol���׳���ͨ��������һ��Ϊ�������缫��ӦʽΪ��O2 + 2H2O + 4e- = 4OH-��������n��O2��=0.01mol��
4Ag+4HNO3+2O2������2��n��Ag��=0.04mol������Ag++e-=Ag��֪ת�Ƶ���Ϊ0.04mol���׳���ͨ��������һ��Ϊ�������缫��ӦʽΪ��O2 + 2H2O + 4e- = 4OH-��������n��O2��=0.01mol��
V��O2��=0.224L�����ݷ�Ӧ4AgNO3+2H2O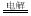 4Ag+4HNO3+2O2��֪��n��H+��=n��HNO3��=0.04mol������Һ�����Ϊ200mL����c��H+��=0��2mol/L��
4Ag+4HNO3+2O2��֪��n��H+��=n��HNO3��=0.04mol������Һ�����Ϊ200mL����c��H+��=0��2mol/L��
���㣺����ԭ���ԭ����ȼ�ϵ�ؼ����ԭ����Ӧ�á�
��������� ����1���绯ѧ���� ����2������ ��������


| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2014-2015ɽ��ʡ�����и߶���ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
����֮Ϊ������ء���ֽ�ʵ�أ�����һ������ֽƬ��Ϊ�����壬����һ�߶�п����������һ�߶ƶ������̡���ֽ�ڵ����ӡ�������ˮ������п��ɵĵ��Һ������ܷ�ӦΪ��Zn+2MnO2+H2O=ZnO+2MnO(OH)������˵����ȷ����
A���õ�ص�����Ϊп
B�����������ӦʽΪ��MnO2 + e-��H2O = MnO(OH) + OH-
C���õ�ط�Ӧ�ж����������������
D���� 0.l mol Zn ��ȫ�ܽ�ʱ���������Һ�ĵ�����ĿΪ 1.204��l023
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ɽ��ʡУ��һ��ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�������
(8��) ��100 mL 0.5 mol/L AlCl3��Һ�У�����100 mL NaOH��Һ���õ�1.56 g��������NaOH��Һ�����ʵ���Ũ�ȡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ɽ��ʡУ��һ��ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
���з�Ӧ�����ӷ���ʽ��ȷ����
A�����Ȼ�����Һ�еμӹ�����ˮ��Al3++4NH3��H2O = AlO2��+4NH4+
B������ϡ���ᷴӦ��2Fe+6 H+= 2 Fe3++3H2��
C��ϡ���������������Һ��Ӧ: Ba2++ OH-+ H++SO42-=BaSO4��+H2O
D��ͭƬ���Ȼ�����Һ��Ӧ: Cu+2Fe3+= Cu2++2Fe2+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ɽ��ʡУ��һ��ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
�����Ȼ�̼��ȡ��ı���ˮ��Һ�еĵ⣬����˵���в���ȷ����
A. ʵ��ʹ�õ���Ҫ�����Ƿ�Һ©��
B. �������Ȼ�̼�е��ܽ�ȱ���ˮ�е��ܽ�ȴ�
C. ������Ȼ�̼��Һ���Ϻ�ɫ
D. ��Һʱ��ˮ�ӷ�Һ©���¿�������������Ȼ�̼��Һ��©���Ͽڵ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ɽ��ʡ�ൺƽ������У�߶���ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
�����£�Ũ�Ⱦ�Ϊ0��1mol��L-1 ��������Һ����CH3COOH ��Һ ��NaOH ��Һ ��CH3COONa��Һ������˵������ȷ����
A����Һ��pH ����>��>��
B��ˮ�������c(OH- )����>��>��
C���ٺ͢۵������Ϻ����Һ��c(H��)+c(CH3COOH) =c(OH- )+c(CH3COO-)
D���ٺ͢ڵ������Ϻ����Һ��c(CH3COOH)+c(CH3COO-)=0��05mol��L-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ɽ��ʡ�ൺƽ������У�߶���ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
���бȽ��У���ȷ����
A��ͬ�¶�ͬ���ʵ���Ũ��ʱ��HF��HCN���룬���Ũ�ȵ������NaF��Һ�� NaCN ��Һ������������
B��0��2 molL��l NH4Cl �� 0��l molL��l NaOH ��Һ�������Ϻ�c (Cl-) > c(NH4+)> c (Na+) > c (OH-) >c (H+)
C��0��1 mol/L pHΪ4��NaHB��Һ�У�c(HB��)>c(H2B)>c(B2��)
D����ͬ���ʵ���Ũ�ȵ�������Һ�У���NH4Al(SO4)2����NH4Cl����CH3COONH4����NH3��H2O��c(NH4+) �ɴ�С��˳���ǣ���>��>��>��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015���ɹų���������ظ�һ��ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
NA��ʾ�����ӵ�����������˵������ȷ����
A��2��3 g����ԭ�ӱ�Ϊ����ʱʧȥ�ĵ�����ΪNA
B���ڳ��³�ѹ�£�1 mol������е�ԭ����Ϊ2NA
C����״����2��24 L����������������Ϊ0��1NA
D���ڳ��³�ѹ�£�62 g Na2O�к���O2��������ΪNA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015����ʡ�����и�һ��ѧ����ĩ��ѧ�Ծ��������棩 ���ͣ������
��16�֣�H2S��һ����ɫ���ж��Ŀ�ȼ�����壬��ˮ��Һ�������ᣨ��Ԫ���ᣩ��
��1��ʵ���ҿ���������������ϡ���ᷴӦ���Ʊ�H2S���塣
�ٸ÷�Ӧ�Ļ�ѧ����ʽΪ ��
�ڶ����H2S������� ��Һ�����գ�������ȼ�յķ�������H2S����������� ��
��2����30% FeCl3��Һ������ҺҲ������H2S���壬��Ӧ����ʽΪ��2FeCl3+H2S = S��+2FeCl2+2HCl��������Һ������ѭ��ʹ�á�
�ٸ÷�Ӧ��H2S�� ������ĸ����
a�����ȶ��� b�������� c�������� d����ԭ��
�ڼ��������Һ���Ƿ���Fe3+�������Լ��� ��
��ǿ���Եķ�����Һ��������FeCl3��һ�ַ�������С�����壬��ѧ����ʽΪ ��
��3����֪��H2S�ڸ����·ֽ�������������H2���ֲ��ij�¶��£�H2S�ֽ�����и����ʵ����ʵ�����ʱ��仯��ϵ��ͼ��ʾ��

�ٱ�ʾH2�������� ���A������B����C������
�������������ķ���ʽΪ ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com