
【题目】室温下,向100 mL 0.1 mol/L NH4Cl溶液中加入下列物质。有关结论正确的是
加入的物质 | 结论 | |
A. | 100 mL 0.1 mol/L盐酸 | 溶液中2c(NH4+)=" " c(Cl-) |
B. | 0.01 mol Na2O2固体 | 反应完全后,溶液pH增大,c(Na+) = 2c(Cl-) |
C. | 100 mL H2O | 由水电离出的c(H+)c(OH-)不变 |
D. | 100 mL 0.1 mol/L NH3H2O | 溶液中 |
A. A B. B C. C D. D
【答案】B
【解析】试题分析:A.向100 mL 0.1 mol/L NH4Cl溶液中加入100 mL 0.1 mol/L盐酸,溶液中存在物料守恒,2c(NH4+) +2 c(NH3·H2O)= c(Cl-),故A错误;B.向100 mL 0.1 mol/L NH4Cl溶液中加入0.01 mol Na2O2固体,过氧化钠与水反应生成0.02mol氢氧化钠,与氯化铵反应生成氨水和氯化钠,剩余0.01molNaOH,溶液显碱性,pH增大,c(Na+) = 2c(Cl-) ,故B正确;C.向100 mL 0.1 mol/L NH4Cl溶液中加入100 mL H2O,促进氯化铵的水解,水的电离受到抑制,由水电离出的c(H+)c(OH-)减小,故C错误;D.向100 mL 0.1 mol/L NH4Cl溶液中加入100 mL 0.1 mol/L NH3H2O,溶液的碱性增强, 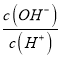 增大,故D错误;故选B。
增大,故D错误;故选B。


科目:高中化学 来源: 题型:
【题目】芳香族化合物A的分子式为C7H6O2,将它与NaHCO3溶液混合微热,有酸性气体产生,那么包括A在内,属于芳香族化合物的同分异构体数目是
A. 2 B. 3 C. 4 D. 5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极。通电一段时间后,在c、d两极上共收集到336 mL (标准状况)气体,且c、d两极产生的气体体积比为1∶2回答:
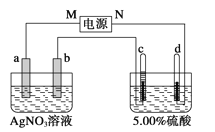
(1)直流电源中,M为__________极。
(2)Pt电极上生成的物质是________,其质量为_______g。
(3)电源输出的电子,其物质的量与电极b、c、d分别生成的物质的物质的量之比为2∶_________∶_________∶_________。
(4)AgNO3溶液的浓度________(填“增大”、“减小”或“不变”,下同),AgNO3溶液的pH_________,硫酸的浓度______________________,硫酸的pH________。
(5)若硫酸的质量分数由5.00%变为5.02%,则原有5.00%的硫酸________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
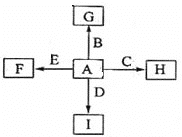
【题目】下图中,A,B,C,D,E是单质,G,H,I,F是B,C,D,E分别和A形成的二元化合物。
已知:①反应C+G![]() B+H能放出大量的热,该反应曾应用于铁轨的焊接;
B+H能放出大量的热,该反应曾应用于铁轨的焊接;
②I是一种常见的温室气体,它和E可以发生反应:2E+I![]() 2F+D,F中E元素的质量分数为60%。
2F+D,F中E元素的质量分数为60%。
回答问题:
⑴①中反应的化学方程式为______________;
⑵化合物I的电子式为_______,它的空间结构是______;
⑶C与过量NaOH溶液反应的离子方程式为____________,反应后溶于与过量化合物I反应的离子方程式为____________________;
⑷E在I中燃烧观察到的现象是_____________________。
⑸1.6gG溶于盐酸,得到的溶液与铜粉完全反应,计算至少所需的铜粉的质量_____________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知酸性条件下有反应:2Cu+=Cu2++Cu。氢气还原氧化铜实验由于反应温度不同,可能产生Cu或Cu2O,两者都是红色固体。某同学对某次氢气还原氧化铜的红色固体产物做了如下实验,实验操作和实验现象列表如下:
加入 试剂 | 稀硫酸 | 浓硫酸 并加热 | 稀硝酸 | 浓硝酸 |
实验 现象 | 红色固体 不反应 | 无色气体 | 无色气体 蓝色溶液 | 红棕色气体 蓝色溶液 |
由此推出本次氢气还原氧化铜实验的产物( )
A. 是Cu B. 是Cu2O C. 一定有Cu,一定有Cu2O D. 一定有Cu2O,可能有Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学利用下图装置对电解氯化铜实验进行了研究。
装置 | 现象 |
| 电解一段时间时,阳极石墨表面产生气体,阴极石墨上附着红色物质,烧杯壁变热,溶液由蓝色变为绿色 |
(1)甲认为电解过程中阳极产生的 是溶液变绿的原因,写出产生该物质的电极反应式: 。
(2)乙查阅资料,CuCl2溶液中存在平衡:Cu2+ + 4Cl_![]() [CuCl4]2_(黄色) ΔH>0。据此乙认为:电解过程中,[CuCl4]2_(黄色)浓度增大,与CuCl2蓝色溶液混合呈绿色。乙依据平衡移动原理推测在电解过程中[CuCl4]2_浓度增大的原因: 。
[CuCl4]2_(黄色) ΔH>0。据此乙认为:电解过程中,[CuCl4]2_(黄色)浓度增大,与CuCl2蓝色溶液混合呈绿色。乙依据平衡移动原理推测在电解过程中[CuCl4]2_浓度增大的原因: 。
(3)丙改用下图装置,在相同条件下电解CuCl2溶液,对溶液变色现象继续探究。
装置 | 现象 |
| 电解相同时间时,阳极石墨表面产生气泡,溶液仍为蓝色;阴极石墨上附着红色物质,溶液由蓝色变为绿色;U型管变热,冷却后阴极附近溶液仍为绿色 |
丙通过对现象分析证实了甲和乙的观点均不是溶液变绿的主要原因。丙否定甲的依据是 ,否定乙的依据是 。
(4)丙继续查阅资料:
i. 电解CuCl2溶液时可能产生[CuCl2]_,[CuCl2]_掺杂Cu2+后呈黄色
ii. 稀释含[CuCl2]_的溶液生成CuCl白色沉淀据此丙认为:电解过程中,产生[CuCl2]_掺杂Cu2+后呈黄色,与CuCl2蓝色溶液混合呈绿色。
丙进行如下实验:
a.取电解后绿色溶液2 mL,加20 mL水稀释,静置5分钟后溶液中产生白色沉淀。
b. 另取少量氯化铜晶体和铜粉,向其中加2 mL浓盐酸,加热获得含[CuCl2]_的黄色溶液。
c. 冷却后向上述溶液……
d. 取c中2 mL溶液,加20 mL水稀释,静置5分钟后溶液中产生白色沉淀。
① a的目的是 。
② 写出b中生成[CuCl2]_的离子方程式: 。
③ 补充c中必要的操作及现象: 。
丙据此得出结论:电解时阴极附近生成[CuCl2]_是导致溶液变绿的原因。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原子晶体的基本结构单元是正二十面体,每个原子与另外五个原子相连,每个面均是正三角形,请分析该晶体的棱数和定点数( )
A. 60、12 B. 12、30 C. 30、12 D. 10、30
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com