
反应C(s)+H2O(g) CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
A.增加C的量
B.将容器的体积缩小一半
C.保持体积不变,充入H2O(g),使体系的压强增大
D.保持压强不变,充入氮气,使容器的体积增大
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源:2016届天津一中高三零月考化学试卷(解析版) 题型:实验题
某化学小组拟采用如下装置(夹持和加热仪器已略去)来电解饱和食盐水,并用电解产生的H2还原CuO粉末来测定Cu的相对原子质量,同时检验氯气的氧化性。

(1)写出甲装置中电解饱和食盐水的离子方程式 。
(2)为完成上述实验,正确的连接顺序为A连________;B连________(填写导管口字母)。
(3)对硬质玻璃管里的氧化铜粉末加热前,需要进行的操作为________________。
(4)若检验氯气的氧化性,则乙装置的a瓶中溶液可以是______________,对应的现象为_______。
乙装置烧杯中发生反应的离子方程式是 。
(5)为测定Cu的相对原子质量,设计了如下甲、乙两个实验方案:精确测量硬质玻璃管的质量为a g,放入CuO后,精确测量硬质玻璃管和CuO的总质量为b g(假设CuO充分反应),实验完毕后:
甲方案:通过精确测量硬质玻璃管和Cu粉的总质量为c g,进而确定Cu的相对原子质量。
乙方案:通过精确测定生成水的质量d g,进而确定Cu的相对原子质量。
①请你分析并回答:________方案所测结果更准确。
你认为不合理的方案的不足之处是_____________________。
②若按合理方案测定的数据计算,Cu的相对原子质量为 。
查看答案和解析>>
科目:高中化学 来源:2016届宁夏回族自治区银川一中高三上学期第二次月考化学试卷(解析版) 题型:填空题
[化学——选修物质结构与性质](15分)碳元素在生产生活中具有非常重要的作用,在新物质的制备中也发挥了举足轻重的作用。碳元素的单质有多种形式,下图依次是C60、石墨和金刚石的结构图:

(1)与碳同周期,且基态原子的核外未成对电子数与碳相等的元素,其基态原子的电子排布式为______。
(2)金刚石、石墨、C60、碳纳米管等都是碳元素的单质形式,它们互为____________。
(3)金刚石、石墨烯(指单层石墨)中碳原子的杂化形式分别为________、________。常温条件下丙烯是气态,而相对分子质量比丙烯小的甲醇,常温条件下却呈液态,出现这种现象的原因是______________。
(4)C60属于________晶体,C60晶体内含有的微粒间作用有_________________。
(5)金刚石晶胞含有________个碳原子。若碳原子半径为r,金刚石晶胞的边长为a,根据硬球接触模型,则r=__________a,列式表示碳原子在晶胞中的空间占有率________(不要求计算结果)。
查看答案和解析>>
科目:高中化学 来源:2016届湖南省高三上学期入学考试化学试卷(解析版) 题型:选择题
下列关于物质或离子检验的叙述正确的是
A.在溶液中加KSCN,溶液显红色,证明原溶液中有Fe3+,无Fe2+
B.气体通过无水硫酸铜,粉末变蓝,证明原气体中含有水蒸气
C.灼烧白色粉末,火焰成黄色,证明原粉末中有Na+,无K+
D.将气体通入澄清石灰水,溶液变浑浊,证明原气体是CO2
查看答案和解析>>
科目:高中化学 来源:2016届广东省等六校高三第一次联考化学试卷(解析版) 题型:填空题
(14分)有机物A可发生如下转化(方框内物质均为有机物,部分无机产物已略去):
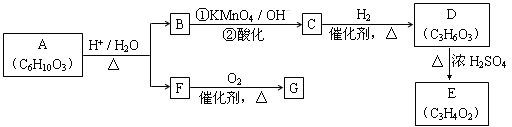
已知: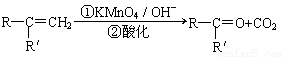 (R、R'可表示烃基或官能团)
(R、R'可表示烃基或官能团)
请回答:
(1)F蒸气密度是相同条件下H2密度的31倍,且分子中无甲基。已知1 mol F与足量钠作用产生H2 22.4 L(标准状况),则F的分子式是________________。
(2)G与F的相对分子质量之差为4,则G的性质是________(填字母)。
a.可与银氨溶液反应
b.可与乙酸发生酯化反应
c.可与氢气发生加成反应
d.1 mol G可与2 mol新制Cu(OH)2发生反应
(3)D能与NaHCO3反应,且两分子D可以反应得到含有六元环的酯类化合物,E可使溴的四氯化碳溶液褪色,则D→E的化学方程式是______________
(4)B的同分异构体较多,写出一种不含甲基能发生银镜反应的同分异构体结构简式: ____________。
(5)A转化为B和F的化学方程式是__________________。
(6)某烃分子H的碳原子数小于10,核磁共振氢谱只有一组峰, 在相同条件下也可发生类似B → C的反应并只生成一种有机物I,I的结构简式: ___________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁省高二上化学试卷(解析版) 题型:选择题
下列叙述中,不正确的是
A.只有非金属原子间才能形成共价键
B.共价化合物中不可能含有离子键
C.单质中不可能含有离子键
D.非金属单质中不一定含有共价键
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江大庆铁人中学高二上9月考化学试卷(解析版) 题型:选择题
现有下列热化学方程式:
①C(s)+O2(g)===CO2(g) ΔH1=-393.5 kJ·mol-1
②2CO(g)+O2(g)===2CO2(g) ΔH2=-566 kJ·mol-1
③CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH3=-890 kJ·mol-1
④CH3CH2OH(l)+3O2(g)===2CO2(g)+3H2O(l) ΔH4=-1 367 kJ·mol-1
下列说法正确的是________。
A.CO(g)的燃烧热比C(s)的燃烧热大
B.ΔH4>ΔH3>ΔH2>ΔH1
C.CO(g)具有的能量比CO2(g)高
D.1 mol C2H5OH蒸气完全燃烧生成CO2和液态水,放出大于1 367 kJ的热量
查看答案和解析>>
科目:高中化学 来源:2016届四川省高三上学期第一次月考化学试卷(解析版) 题型:选择题
如表所示的五种元素中,W、X、Y、Z为短周期元素,这四种元素的原子最外层电子数之和为22。下列说法正确的是
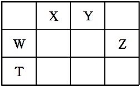
A.X、Y、Z三种元素最低价氢化物的沸点依次升高
B.由X、Y和氢三种元素形成的化合物中只有共价键
C.物质WY2、W3X4、WZ4均有熔点高、硬度大的特性
D.T元素的单质具有半导体的特性,T与Z元素可形成化合物TZ4
查看答案和解析>>
科目:高中化学 来源:2016届山东省滕州市高三第一学期开学初检测化学试卷(解析版) 题型:填空题
煤化工中两个重要反应为①C(s)+H2O(g) H2(g)+CO(g)ΔH=+131.3 kJ·mol-1,②CO(g)+ H2O(g)
H2(g)+CO(g)ΔH=+131.3 kJ·mol-1,②CO(g)+ H2O(g) CO2(g)+ H2(g)。
CO2(g)+ H2(g)。
(1)下列说法正确的是 。
A.当反应①的容器中混合气体的密度不再变化时反应达到最大限度
B.反应②的熵变△S>0
C.反应①中增加C固体的量能增大反应速率
D.在反应中②及时分离出产生的H2对正反应速率无影响
(2)若工业上要增加反应①的速率,最经济的措施为 。
(3)现将不同量的CO(g)和H2O(g)分别通入2L恒容密闭容器中进行反应,得到如下三组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/ min | ||
CO | H2O | H2 | CO2 | |||
I | 650 | 4 | 2 | 1.6 | 1.6 | 5 |
Ⅱ | 900 | 2 | 1 | 0.5 | 0.5 | 3 |
Ⅲ | 900 | a | b | c | d | t |
①实验I中,从反应开始到反应达到平衡时,H2O的平均反应速率为___。
②CO(g)和H2O(g)反应的△H 0(填“大于”、“小于”或“等于”)
③实验III中,若平衡时,CO的转化率大于水蒸气,则a、b必须满足的关系是______,与实验Ⅱ相比,化学平衡常数 (填“增大”、“减小”或“不变”)。
④若在900℃时,实验II反应达到平衡后,向此容器中再加入1 mol CO、0.5 mol H2O、0.2 mol CO2、0.5 mol H2,平衡向__________方向移动(填“正反应”、“逆反应”“不移动”)。
(4)CO、H2可用于甲醇和甲醚,其反应为(m、n均大于0):
反应①:CO(g)+2H2(g) CH3OH(g)ΔH= -mkJ·mol-1
CH3OH(g)ΔH= -mkJ·mol-1
反应②: 2CO(g)+4 H2(g) CH3OCH3(g)+H2O(g)ΔH=-nkJ·mol-1
CH3OCH3(g)+H2O(g)ΔH=-nkJ·mol-1
反应③:2CH3OH(g) CH3OCH3(g)+ H2O(g)△H<0
CH3OCH3(g)+ H2O(g)△H<0
则m与n的关系为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com