
(8分)(2011·重庆万州调研)为确认C6H5OH、H2CO3和CH3COOH的酸性强弱,某学生设计了如图所示的装置,一次实验即可达到目的(不必选其他酸性物质)。
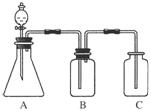
请据此实验回答:
(1)锥形瓶中装某可溶性正盐溶液,分液漏斗中所盛试剂应为________。
(2)装置B所盛的试剂是________,其作用是______________________________。
(3)装置C所盛的试剂是________,C中反应的离子方程式是______________________。
科目:高中化学 来源: 题型:
(8分)(2011·扬州调研)在2 L密闭容器中反应2NO2(g) 2NO(g)+O2(g)在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃,NO、O2的起始浓度都为0,NO2的浓度(mol·L-1)随时间(min)的变化如图所示。请回答下列问题:
(1)对比实验Ⅰ、Ⅱ和Ⅲ,得出的下列结论中正确的是( )
A.实验Ⅱ和实验Ⅰ相比,可能隐含的反应条件是:反应容器的体积缩小了
B.实验Ⅱ和实验Ⅰ相比,可能隐含的反应条件是:使用效率更高的催化剂
C.实验Ⅰ条件下该反应的平衡常数大于实验Ⅲ条件下该反应的平衡常数
D.对比实验Ⅰ和Ⅲ可知,该反应是吸热反应
(2)若实验Ⅰ中NO2的起始浓度改为1.2mol·L-1,其他条件不变,则达到平衡时所需用的时间________40 min(填“大于”、“等于”或“小于”),NO2的转化率将________(填“增大”、“减小”或“不变”)。
(3)若实验Ⅰ中达平衡后,再向密闭容器中通入2 mol由物质的量之比为1∶1组成的NO2与NO混合气体(保持温度不变),则平衡将________移动,新平衡状态时NO2的物质的量浓度为________mol·L-1。
(4)若将实验Ⅲ所得的平衡混合气体通入足量的水中,欲使气体被完全吸收则至少应同时通入标准状况下的空气________L。(设空气中N2与O2体积比4∶1)
查看答案和解析>>
科目:高中化学 来源: 题型:
(8分)(2011·泰州模拟)某化学反应2AB+D在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
| 实验 序号 | 时间 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800 | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800 | c3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
根据上述数据,完成下列填空:
(1)在实验1中,反应在10 min~20 min时间内平均速率为________mol·L-1·min-1。
(2)在实验2中,A的初始浓度c2=________mol·L-1,反应经20min就达到平衡,可推测实验2中还隐含的条件是________。
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3________v1,且c3________1.0mol/L(填“=”、“>”或“<”)
(4)比较实验4和实验1,可推测该反应是________反应(填“吸热”或“放热”),理由是________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(8分)(2011·苏北四市调研)煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。
(1)将水蒸气通过红热的碳即可产生水煤气,反应为:
C(s)+H2O(g) CO(g)+H2(g)
ΔH=+131.3 kJ·mol-1,
ΔS=+133.7 J·(K·mol)-1
①该反应能否自发进行与________有关;
②一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是________(填字母,下同)。
a.容器中的压强不变
b.1 mol H—H键断裂的同时断裂2 mol H—O键
c.v正(CO)=v逆(H2O)
d.c(CO)=c(H2)
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2 L的恒容密闭容器中,进行反应
CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
| 实验 组 | 温度/ ℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| H2O | CO | H2 | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
①实验1中以v(H2)表示的反应速率为_________________________________________。
②若实验3要达到与实验2相同的平衡状态(即各物质的质量分数分别相等),且t<3min,则a、b应满足的关系是________(用含a、b的数学式表示)。
(3)目前工业上有一种方法是用CO2来生产甲醇。一定条件下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g),右图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2,下列措施中能使c(CH3OH)增大的是________。
a.升高温度
b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来
d.再充入1 mol CO2和3 mol H2
查看答案和解析>>
科目:高中化学 来源:2012届高考化学一轮复习《化学反应速率与化学平衡》专题综合测试(苏教版) 题型:填空题
(8分)(2011·泰州模拟)某化学反应2A B+D在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
| 实验 序号 | 时间 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800 | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800 | c3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
查看答案和解析>>
科目:高中化学 来源:2012届高考化学一轮复习《化学实验基础》专题综合测试(苏教版) 题型:实验题
(8分)(2011·苏州模拟)已知A和B两支试管的溶液中共含有K+、Ag+、Mg2+、Cl-、OH-、NO3-六种离子。向试管A的溶液中滴入酚酞试液呈粉红色。请回答下列问题:
(1)试管A的溶液中所含上述离子共有________种。
(2)若向某试管中滴入稀盐酸产生沉淀,则该试管为________(填“A”或“B”)。
(3)若向试管B的溶液中加入合适的药品,过滤后可以得到相应的金属和仅含一种溶质的溶液,则加入的药品是________(填化学式)。
(4)若将试管A和试管B中的溶液按一定体积比混合过滤后,蒸干滤液可得到一种纯净物,则混合过程中发生反应的离子方程式为
________________________________________________________________________、______________________________________________________________________。
(5)若试管A和试管B中共有四种物质按等物质的量溶解于试管中,再将A和B中的溶液混合过滤,所得滤液中各种离子的物质的量之比为________。
(6)若向由试管A的溶液中阳离子组成的碳酸氢盐溶液中,滴入少量Ba(OH)2溶液,则发生反应的离子方程式为________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com