
| A. | 一定含Ag+ | B. | 一定含SO42- | C. | 含有Ag+或SO42- | D. | 含有Ag+和SO42- |
 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:选择题
| A. | 参加反应的Fe2+全部作还原剂 | |
| B. | 生成1.5molFe3O4时,反应转移电子 6mol电子 | |
| C. | 方程式中a=2 | |
| D. | 反应中被氧化的元素是Fe,被还原的元素是S和O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 豆科作物的根瘤菌对空气中氮的固定 | |
| B. | 将NO2气体冷却后颜色会变浅 | |
| C. | 熟石膏转化为生石膏 | |
| D. | 工业制液态氧 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol/L的甲酸溶液中氢离子浓度约为10-2 mol/L | |
| B. | 甲酸能与水以任意比互溶 | |
| C. | 10 mol/L甲酸恰好与10 mol/LNaOH溶液完全反应 | |
| D. | 在一定温度下,甲酸的导电性比盐酸溶液弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 判定加热时有无晶体飞溅 | B. | 判断是否已失去全部结晶水 | ||
| C. | 判断是否有其他杂质 | D. | 防止失水后又吸潮 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2具有还原性,可用于漂白纸浆 | |
| B. | NH4Cl受热易分解,可用作氮肥 | |
| C. | MgO熔点高,可用作耐高温材料 | |
| D. | KAl(SO4)2•12H2O易溶于水,可用作净水剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
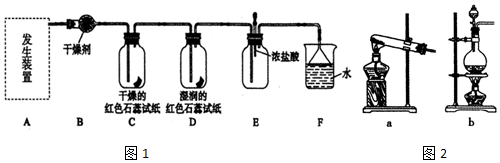
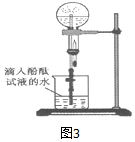
查看答案和解析>>
科目:高中化学 来源: 题型:推断题


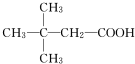 .(用结构简式表示)
.(用结构简式表示)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com