
| | A | B | C | D |
| X | FeCl2 | FeCl3溶液 | Fe | Na2SO4溶液 |
| Y | FeCl3 | CuCl2 | Al | Na2CO3 |
| Z | Cl2 | Fe | NaOH溶液 | BaCl2 |
 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案科目:高中化学 来源:不详 题型:实验题
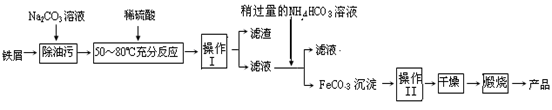
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.11.2 g | B.16.8 g | C.33.6 g | D.5.6 g |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
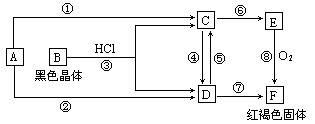
查看答案和解析>>
科目:高中化学 来源:不详 题型:判断题
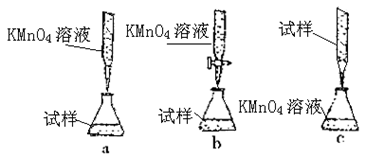
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.2∶7 | B.7∶2 |
| C.5∶2 | D.2∶5 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Fe2O3 | B.Fe3O4 | C.Fe4O5 | D.Fe5O7 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.硫酸铁溶液与氢氧化钡溶液反应:Fe3++3OH-====Fe(OH)3↓ |
| B.硫化钠溶液与氯化铁溶液反应:2Fe3++3S2-====Fe2S3 |
C.过量的铁与很稀的硝酸溶液反应无气体放出:4Fe+10H++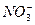 ====4Fe2++3H2O+ ====4Fe2++3H2O+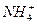 |
| D.硫化氢气体通入氯化亚铁溶液:H2S+Fe2+====FeS↓+2H+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 FeSO4+Ti(SO4)2+3H2O?
FeSO4+Ti(SO4)2+3H2O?| A.防止Fe2+被氧化? |
| B.防止Ti(SO4)2水解 |
| C.减少FeSO4·7H2O的溶解量 ? |
| D.减少Ti(SO4)2的溶解量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com