
A、B、C、D、E五种元素为1~18号元素。已知:它们的原子序数依次增大,A、B两种元素的核电荷数之差等于它们的原子最外层电子数之和;B原子最外层电子数比其次外层电子数多2;C元素原子的电子层数及最外层电子数都比E元素的少1;D和E的原子序数之和为30。它们两两形成的化合物有甲、乙、丙、丁四种。这四种化合物中原子个数比如下表:
甲 乙 丙 丁
化合物中各元素原子个数比 A和C 1∶1 B和A 1∶2 D和E 1∶3 B和E 1∶4
(1)写出元素符号:A__________,B__________,C__________,D__________,E__________。
(2)向甲的水溶液中加入MnO2,氧化产物是____________________。
(3)已知有机物乙的分子为平面结构,键角都为120°,实验室制取乙的化学方程式为____________________。
(4)丙的水溶液呈酸性,与饱和NaHCO3溶液反应会产生大量的气体和难溶物,有关离子方程式是____________________。
(5)写出E原子的电子排布式____________________。
(1)H C O Al Cl (2)O2 (3)C2H5OH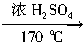 C2H4↑+H2O
C2H4↑+H2O
(4)Al3++3HCO-3=Al(OH)3↓+3CO2↑ (5)1s22s22p63s23p5
【解析】
试题分析:A、B、C、D、E都为1~18号元素,B原子最外层电子数比其次外层电子数多2,则B的电子层结构为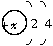 ,B为6号元素C;A、B两元素的核电荷数之差等于它们的原子最外层电子数之和,且A、B形成的化合物乙为有机物,则A为H;D和E的原子序数之和为30,它们形成化合物丙的化学式为DE3,只有AlCl3符合题意,则D为Al,E为Cl;C元素原子的电子层数及最外层电子数都比E的少1,则C为O。确定五种元素后其他几问可顺利解答。
,B为6号元素C;A、B两元素的核电荷数之差等于它们的原子最外层电子数之和,且A、B形成的化合物乙为有机物,则A为H;D和E的原子序数之和为30,它们形成化合物丙的化学式为DE3,只有AlCl3符合题意,则D为Al,E为Cl;C元素原子的电子层数及最外层电子数都比E的少1,则C为O。确定五种元素后其他几问可顺利解答。
考点:考查元素周期表的结构、核外电子的排布规律以及化学用语的书写
点评:该是高考中的常见题型,属于中等难度的试题,本题综合性强,贴近高考。该题主要是以“周期表中元素的推断”为载体,考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
容器温度 浓度 |
a容器 400℃ |
b容器 425℃ |
c容器 450℃ |
d容器 475℃ |
e容器 500℃ |
| c(O2) | 0.8 | 0.6 | 0.3 | 0.5 | 0.7 |
| c(SO3) | 0.4 | 0.8 | 1.4 | 1.0 | 0.6 |

| c2(SO3) |
| c2(SO2)×c(O2) |
| c2(SO3) |
| c2(SO2)×c(O2) |


查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:



| ①O3 | ②Zn,H2O |




查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com