
将SO2分别通入下列4种溶液中,有关说法正确的是( )
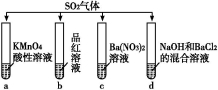
A.试管a中实验可以证明SO2具有漂白性
B.试管b中溶液褪色,说明SO2具有强氧化性
C.试管c中能产生白色沉淀,说明SO2具有还原性
D.试管d中能产生白色沉淀,该沉淀完全溶于稀硝酸
科目:高中化学 来源:2014高考化学名师知识点精编 专题21化学实验基础练习卷(解析版) 题型:选择题
下列装置和操作能达到实验目的的是( )

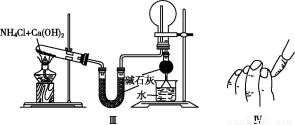
A.实验Ⅰ:制取并收集氢气
B.实验Ⅱ:验证葡萄糖的还原性
C.实验Ⅲ:实验室制氨气并收集干燥的氨气
D.实验Ⅳ:检查碱式滴定管是否漏液
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题18烃及其有机物的命名练习卷(解析版) 题型:选择题
丁香油酚的结构简式是
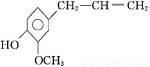 ,该物质不应有的化学性质是( )
,该物质不应有的化学性质是( )
①可以燃烧
②可以跟溴加成
③可以使酸性KMnO4溶液褪色
④可以跟NaHCO3溶液反应
⑤可以跟NaOH溶液反应
⑥可以在碱性条件下水解
A.①③ B.③⑥ C.④⑤ D.④⑥
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题17氮及其化合物练习卷(解析版) 题型:选择题
某混合气体中可能含有Cl2、O2、SO2、NO、NO2中的两种或多种气体。现将此无色混合气体通过品红溶液后,品红溶液褪色,把剩余气体排入空气中,气体很快变为红棕色。下列对原混合气体成分的判断中正确的是( )
A.肯定只有SO2和NO B.肯定有Cl2、O2和NO2
C.可能有Cl2和O2 D.肯定只有NO
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题16硫及其化合物练习卷(解析版) 题型:填空题
硫酸和硝酸是中学阶段常见的两种强酸,请就两者与金属铜的反应情况回答下列问题:
(1)在100 mL 18 mol·L-1的浓硫酸中加入过量的铜片,加热使之充分反应,产生的气体在标准状况下的体积可能是 (填写代号);
A.7.32 LB.6.72 LC.20.16 LD.30.24 L
(2)若使上述反应中剩余的铜片继续溶解,可将溶液稀释并向其中加入硝酸钠,写出反应的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题15富集在海水的元素-氯溴碘练习卷(解析版) 题型:选择题
对下列事实的解释正确的是( )
A.氯气可以使湿润的有色布条褪色,是因为氯气具有漂白性
B.用氢氟酸雕刻玻璃,是由于氢氟酸能与二氧化硅反应
C.向50 mL 18 mol·L-1 的H2SO4溶液中加入足量的铜片加热充分反应后,被还原的H2SO4的物质的量等于0.45 mol
D.常温下,浓硝酸可以用铝制容器贮存,说明铝与浓硝酸不反应
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题14无机非金属材料-碳和硅练习卷(解析版) 题型:填空题
硅酸钠是一种重要的无机功能材料,某研究性学习小组设计的利用海边的石英砂(含氯化钠、氧化铁等杂质)制备硅酸钠的流程如下:
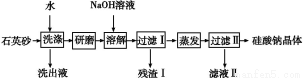
(1)石英砂加水洗涤的目的是 。
研磨后加入NaOH溶液溶解的离子方程式是 。
(2)实验室进行蒸发操作要用到的仪器有铁架台(含铁圈)、 和 。
(3)残渣Ⅰ的成分是 (填化学式)。将残渣Ⅰ溶于盐酸,再加入NaOH溶液得到沉淀,将该沉淀加入到NaClO和NaOH混合溶液中可制得一种优质净水剂,完成反应的离子方程式: + ClO-+ OH- + Cl-+ H2O
+ Cl-+ H2O
(4)按上述流程制得的硅酸钠晶体可表示为Na2O·nSiO2,若石英砂的质量为10.0 g,其中含SiO2的质量分数为90%,最终得到硅酸钠晶体15.2 g,则n= 。
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题13铁、铜及其重要化合物练习卷(解析版) 题型:选择题
下列实验操作及现象与实验结论一致的是( )
选项实验操作及现象实验结论
A向某溶液中加入盐酸酸化的BaCl2溶液,生成白色沉淀该溶液中不一定含有S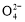
B光洁的铁钉放在冷的浓硫酸中,无明显现象铁钉与冷的浓硫酸不反应
C将少量的溴水分别滴入FeCl2溶液、NaI溶液中,再分别滴加CCl4振荡静置,下层分别呈无色和紫红色氧化性:Br2>Fe3+>I2
D向浓度均为0.1 mol·L-1的KCl、KI混合溶液中滴加1~2滴0.01 mol·L-1 的AgNO3溶液,产生的沉淀呈黄色 Ksp(AgCl)<Ksp(AgI)
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题9电化学原理练习卷B(解析版) 题型:填空题
某中学课外兴趣小组用惰性电极电解饱和食盐水(含少量Ca2+ 、Mg2+)作系列探究,装置如图所示:
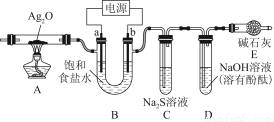
(1)电解时,甲同学发现电极a附近溶液出现浑浊,请用离子方程式表示原因________________________________________________________________________。
(2)一段时间后,你认为C中溶液可能出现的现象是________________________,请用离子方程式表示原因______________________________________。
(3)实验结束后,乙同学将A中的物质冷却后加入到H2S溶液中发现有气泡出现,但加入到稀盐酸中却没有任何现象。请用化学方程式和简要的文字解释原因:________________________________________________________________________________________________________________________________________________。
(4)随着反应的进行,兴趣小组的同学们都特别注意到D中溶液红色逐渐褪去。他们对溶液红色褪去的主要原因提出了如下假设,请你完成假设二。
假设一:B中逸出的气体与水反应生成的物质有强氧化性,使红色逐渐褪去;
假设二:___________________________________________________。
(5)请你设计实验验证上述假设一,写出实验步骤及结论:________________________________________________________________________________________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com