
X、Y、Z代表三种元素的原子,X、Y有相同的电子层,Y、Z最外层电子数相同,已知三种元素的原子最外层电子数之和为17,三种元素的质子数之和为31。则X、Y、Z可能是
A N、O、S B Cl、N、P C Be、F、Cl D F、N、P
科目:高中化学 来源: 题型:
利用如图所示装置可以模拟钢铁的电化学防护。下列说法正确的是
 A.若X为锌棒,开关K置于M处,铁极发生还原反应
A.若X为锌棒,开关K置于M处,铁极发生还原反应
B.若X为碳棒,开关K置于N处,X极发生还原反应
C.若X为碳棒,开关K置于N处,可加快铁的腐蚀
D.若X为锌棒,开关K置于M处,可加快铁的腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
火力发电厂释放出大量氮氧化物(NOx)、SO2和CO2等气体会造成环境问题。对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的。
(1)脱硝。利用甲烷催化还原NOx:
CH4(g) + 4NO2(g) =4NO(g) + CO2(g) + 2H2O(g) △H1=-574 kJ·mol-1
CH4(g) + 4NO(g) =2N2(g) + CO2(g) + 2H2O(g) △H2=-1160 kJ·mol-1
甲烷直接将NO2还原为N2的热化学方程式为 。
(2)脱碳。将CO2转化为甲醇:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3
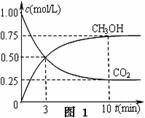
①在一恒温恒容密闭容器中充入1 mol CO2和3 mol H2进行上述反应。测得CO2和CH3OH(g)浓度随时间变化如图1所示。回答:0~10 min内,氢气的平均反应速率为
mol/(L·min);第10 min后,保持温度不变,向该密闭容器中再充入1 mol CO2(g)和1 mol H2O(g),则平衡 (填“正向”、“逆向”或“不”)移动。
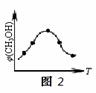
②取五份等体积的CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图2所示,则上述CO2转化为甲醇的反应的△H3 0(填“>”、“<”或“=”)。
(3)脱硫。利用Na2SO3溶液可脱除烟气中的SO2。Na2SO3可由NaOH溶液吸收SO2制得。NaOH溶液吸收SO2的过程中,pH随n(SO32-)︰n(HSO3﹣)变化关系如下表:
| n(SO32﹣)︰n(HSO3﹣) | 91︰9 | 1︰1 | 9︰91 |
| pH | 8.2 | 7.2 | 6.2 |
① 由上表判断,NaHSO3溶液显 性, 用化学平衡原理解释: 。
② 当溶液呈中性时,离子浓度关系正确的是(选填字母): 。
a.c(Na+)=2c(SO32-)+c(HSO3-)
b.c(Na+) > c(HSO3-) > c(SO32-) > c(H+) = c(OH-)
c.c(Na+) + c(H+) = c(SO32-) + c(HSO3-) + c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
已知某溶液中存在OH-、H+、NH4+、Cl- 四种离子。某同学推测其离子浓度大小顺序有如下关系:
①.c(Cl-)>c(NH4+)>c(H+)>c(OH-) ②.c(Cl-)>c(NH4+)>c(OH-)>c(H+)
③.c(NH4+)>c(Cl-)>c(OH-)>c(H+) ④.c(Cl-)>c(H+)>c(NH4+)>c(OH-)
填写下列空白:
(1)若溶液中只溶解了一种溶质,则该溶质是_____________________(填化学式)上述四种离子浓度的大小关系为_____________(填序号)
(2)若上述关系中③是正确的,则溶液中的溶质为_____________________(填化学式)
(3)若该溶液是由体积相等的稀盐酸和氨水混合而成,恰好呈中性,则混合前c(HCl)________c(NH3·H2O)(填“大于”“小于”或“等于”,下同),混合前酸中c(H+)和碱中c(OH-)的关系为c(H+)______________c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
已知短周期元素的离子 A2+,B+,C3-,D- 都具有相同的电子层结构,则下列叙述正确的是
A.单质的还原性A>B>D>C B.原子序数D>C>B>A
C.原子半径A>B>D>C D.离子半径C>D>B>A
查看答案和解析>>
科目:高中化学 来源: 题型:
如右图所示装置中:(1)正极材料
负极电极反应式为
电池的总反应离子方程式为
(2)当原电池工作一段时间产生标准状况下H2 为6.72L时,
转移电子 mol;此时消耗负极材料 克

查看答案和解析>>
科目:高中化学 来源: 题型:
下列对物质用途的描述中,错误的是( )
A.铝可用于冶炼某些熔点较高的金属
B.Na2O2可用作漂白剂
C.碱石灰可用于干燥CO2、O2等气体
D.小苏打可用于治疗胃酸过多
查看答案和解析>>
科目:高中化学 来源: 题型:
已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去)。则W、X不可能是( )

| 选项 | W | X |
| A | 盐酸 | Na2CO3溶液 |
| B | 稀HNO3 | Fe |
| C | CO2 | Ca(OH)2溶液 |
| D | O2 | Na |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列操作不能达到目的的是( )
| 选项 | 目的 | 操作 |
| A | 配制100 mL 1.0 mol·L-1 CuSO4溶液 | 将25 g CuSO4·5H2O 溶于100 mL蒸馏水中 |
| B | 除去KNO3 中少量NaCl | 将混合物制成热的饱和 溶液,冷却结晶,过滤 |
| C | 在溶液中将MnO 完全转化为Mn2+ | 向酸性KMnO4溶液 中滴加H2O2溶液至 紫色消失 |
| D | 确定NaCl溶液中是 否混有Na2CO3 | 取少量溶液滴加CaCl2 溶液,观察是否出现白 色浑浊 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com